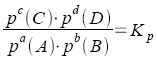Die Abschnitte 12.1 bis 12.8 bringen Anwendungen des Massenwirkungsgesetzes auf chemische Gleichgewichte.
Chemische Reaktionen können umkehrbar sein.
So reagieren als typisches Beispiel Alkohole (Alkanole) mit Säuren zu Estern und Wasser. Andererseits werden Ester durch Wasser zu Alkohol und Säure hydrolysiert ("verseift").
![]()
Der Doppelpfeil deutet die beiden Richtungen der Reaktion an.
Bei den Reaktionsteilnehmern stellt sich ein chemisches Gleichgewicht ein. Das System ist im Gleichgewicht, wenn gerade so viel Ester gebildet wird, wie gleichzeitig wieder verseift wird.
Im Zustand des Gleichgewichts erscheint das System äußerlich in Ruhe; es liegen ständig gleiche Massen an Reaktionsteilnehmern vor, der Anteil etwa an Ester bleibt unverändert. Im Inneren ist das System jedoch in Bewegung, es laufen beide Reaktionen im Sinne des Doppelpfeils mit gleicher Geschwindigkeit ab ("dynamisches Gleichgewicht").
Guldberg und Waage fanden 1876 eine für alle chemischen Gleichgewichtsreaktionen gültige rechnerische Beziehung, das
| Massenwirkungsgesetz ("MWG") Chemische Reaktionen sind abgelaufen, im Zustand eines Gleichgewichtes, wenn das Produkt der Stoffmengen der Endstoffe geteilt durch das Produkt der Stoffmengen der Ausgangsstoffe konstant ist. Gleichgewichtszustände sind temperaturabhängig. |
Für das Beispiel einer Veresterung lautet somit die Formulierung:
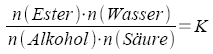
Der Zahlenwert von K, der Gleichgewichtskonstanten oder Massenwirkungskonstanten, ist für jede Reaktion charakteristisch. K ist temperaturabhängig.
Zahlenwert für K in Tabellenwerken.
Allgemeine Form des Massenwirkungsgesetzes mit den Stöchiometrischen Zahlen a, b, c, d für die Reaktion
![]()
|
84 |
|
Statt der Stoffmenge n gehen in das MWG auch der Teilchenzahl proportionale Größen ein:
Stoffmengenkonzentration c (Lösung), dann
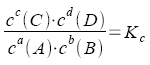
Druck p (Gasreaktionen, Daltonsches Gesetz), dann