Einzelne wichtige Halogenalkane
Unter den technisch bedeutsamen Halogenalkanen überwiegen die Chloralkane, da Chlor das billigste Halogen ist. Bromierte und jodierte Verbindungen sind nur dann anzutreffen, wenn besondere Eigenschaften gewünscht werden, die mit Chloralkanen nicht erreichbar sind.
In der Technik liegt die Bedeutung der Halogenalkane im wesentlichen auf zwei Gebieten:
1. Ausgangs- oder Zwischenprodukte für Synthesen. Hier sind es die Monochloralkane.
2. Ausgezeichnete Lösungsmittel. Hier sind besonders die mehrfach chlorierten Alkane geeignet. Neuerdings haben auch Chlor-fluor-alkane an Bedeutung gewonnen.
Methylchlorid CH3Cl (Chlormethan) entsteht bei der Chlorierung des Methans oder der Veresterung von CH3OH. Handelsübliches CH3Cl wird in Stahlflaschen unter Druck geliefert.
Als Reaktionskomponente wird es bei den Reaktionen nach Wurtz, Friedel-Crafts und Grignard sowie bei der Herstellung von Siliconen und Methylcellulose eingesetzt, allgemein überall dort, wo eine CH3-Gruppe auf eine andere Verbindung übertragen werden soll; CH3Cl ist ein Methylierungsmittel.
Methylbromid CH3Br ( Brommethan) ist ein starkes Nerven- und Gehirngift. Es kann als Methylierungsmittel besonders im Laboratorium gebraucht werden, da es reaktionsfähiger als CH3Cl ist.
Mehyljodid CH3J (Jodmethan) ist das reaktionsfähigste Methylierungsmittel. Es kann als Methanol, Jod und rotem Phosphor hergestellt werden. Es wird gewöhnlich in Ampullen geliefert, die vor dem Öffnen gekühlt werden müssen.
Ethylchlorid C2H5Cl (Chlorethan, Chlorethyl) gewinnt man technisch in großen Mengen aus Ethylen durch Anlagerung von HCl:
CH2=CH2 + HCl ─ 90°C → H3C-CH2-Cl Katalysator: AlCl3/FeCl3 auf Tonscherben
Ethylchlorid ist Ausgangsstoff für Bleitetraethyl Pb(C2H5)4, das als Antiklopfmittel dem Benzin zugesetzt wird. Als Ethylierungsmittel, z. B. bei der Herstellung von Ethylcellulose, und Kältemittel findet Ehtylchlorid weitere Verwendung.
Bringt man einige Tropfen C2H5Cl auf die Haut, verdampft es und erzeugt dabei so viel Verdunstungskälte, dass das Gewebe in unmittelbarer Umgebung gefriert und eine gewisse Schmerzunempfindlichkeit erreicht wird; Anwendung des Ethylchlorids als Lokalnarkotikum auf der Haut, z. B. beim Schneiden von Furunkeln.
Ethylbromid C2H5Br und Ethyljodid C2H5J sind wichtige reaktionsfähige Verbindungen bei Synthesen im Laboratorium.
Methylenchlorid CH2Cl2 (Dichlormethan) ist zu einem sehr bedeutsamen Lösungsmittel geworden, nachdem seine Herstellung aus Methan durch Chlorierung möglich wurde. Es ist das praktisch einzige niedrigsiedende, unbrennbare Lösungsmittel und hat deswegen im Laboratorium feuergefährliche Lösungsmittel wie Ether und Benzine zum Teil verdrängt.
Pflanzliche und tierische Öle und Fette werden von Methylenchlorid leicht gelöst. Es wird daher zum Entfetten von Leder, Wolle und Metallen (vor deren Lackierung) eingesetzt. Das Lösungsvermögen umfaßt auch Harze, Kautschuk, einige Kunststoffe und Lacke.
Aus zerkleinerten Samen und Kernen von Früchten kann man mittels Methylenchlorid Öle und Fette extrahieren; aus diesen lässt es sich anschließend leicht zurückgewinnen. Beim Extrahieren (Ausschütteln) organischer Verbindungen im Laboratorium sollte man einige Vorteile des Methylenchlorids als Extraktionsmittel gegenüber Ether oder Benzinen erkennen; es ist leicht siedend, unbrennbar, mit Wasser nicht mischbar, relativ ungiftig und bildet keine Peroxide. Da es schwerer als Wasser ist, findet man die organische Phase nicht, wie beim Ether, über dem Wasser, sondern als untere Schicht. Oberhalb 60 °C wird Methylenchlorid allerdings mit Wasser langsam zersetzt (verseift).
Chloroform CHCl3 (Trichlormethan), für technische Verwendungen durch Chlorierung von Methan hergestellt, hat als Lösungs- und Extraktionsmittel dieselbe Bedeutung und Eigenschaften wie Methylenchlorid, besitzt allerdings einen etwas höheren Siedepunkt.
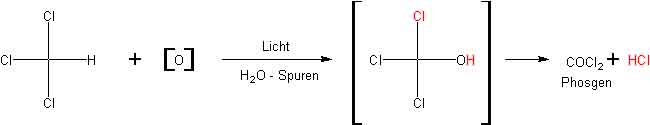
Chloroformdämpfe, obwohl unbrennbar, dürfen nicht in brennende Flammen (Bunsenbrenner) gelangen, da sie zu HCl und dem stark giftigen Phosgen COCl2 zersetzt werden. Auch die Flüssigkeit Chloroform kann sich bei Belichtung und Anwesenheit von Luft und Feuchtigkeit in HCl und Phosgen zersetzen:

Chloroform ist ein wichtiges Narkotikum bei Operationen. Da es zersetzlich ist und dabei das giftige Phosgen abspaltet, wird das handelsübliche Produkt für medizinische Zwecke in braunen Flaschen mit einem Zusatz von 1 % Ethylalkohol geliefert. Eventuell im Chloroform entstandenes Phosgen reagiert sofort mit dem Ethylalkohol:
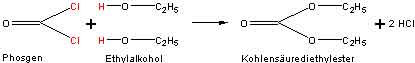
Bromoform CHBr3 hat nur geringe Bedeutung.
Jodoform CHJ3 bildet gelbe, wasserunlösliche Blättchen mit durchdringendem Geruch und dem Schmelzpunkt 119 °C. Es wird häufig als Lösung an Stelle von Jodtinktur in der Wundbehandlung zum Desinfizieren angewandt. Die Technische Darstellung des Jodoforms geschieht mittels einer interessanten Elektrolyse. Eine Lösung von Kaliumjodid in Ethanol/Wasser oder Aceton/Wasser wird bei 70 °C unter ständigem Durchleiten eines CO2-Stroms (Einstellen eines bestimmten pH-Wertes) elektrolysiert. An der Anode wird dabei Jodoform gebildet.
Tetrachlorkohlenstoff CCl4 (Tetrachlormethan, Kohlenstofftetrachlorid) ist auf Grund seines vielseitigen Lösungsvermögens für Öle, Fette, Harze, Wachse, Pech, Teer und Bitumen und seiner Unbrennbarkeit das am häufigsten verwendete chlorierte Lösungsmittel. Bei der Metallentfettung und der Reinigung von Geweben und Leder (chemische Reinigung) findet es ausgedehnte Anwendung.
Tetrachlorkohlenstoff ist ein gutes Feuerlöschmittel (Tetra-Feuerlöscher); dabei ist aber zu beachten, dass es sich in Flammen zersetzt und merkliche Mengen des giftigen Phosgens liefert. Erwähnt sei auch die Bedeutung des CCl4 als Ausgangsstoff für die Herstellung von Chlor-fluor-alkanen.
Technisch wird es nach zwei Verfahren gewonnen:
1. Chlorierung von Methan:
|
CH4 + 4Cl2 → CCl4 + 4HCl |
2. Chlorierung von Schwefelkohlenstoff CS2:
| 1.Stufe | CS2 + 3Cl2 → CCl4 + S2Cl2 |
| 2.Stufe | 2S2Cl2 + CS2 → CCl4 + 6S |
Das Verfahren hat verschiedene Vorteile: Es entsteht kein HCl; das in der 1. Stufe gebildete S2Cl2 Dischwefeldichlorid reagiert mit überschüssigem CS2, so dass das gesamte eingesetzte Chlor an Kohlenstoff gebunden wird. Den gebildeten Schwefel lässt man während der Reaktion auskristallisieren; auf diese Weise zieht man die Reaktion auf die Seite des Endprodukts (CCl4) und erreicht dadurch hohe Ausbeuten. Der Schwefel wird wieder in CS2 überführt.
1,2-Dichlorethan C2H4Cl2, auch Ethylenchlorid genannt (Obwohl es keine Doppelbindung im Molekül enthält), ist ein gutes Lösungs- und Extraktionsmittel. Es wird in großen Mengen als Ausgangsstoff für Vinylchlorid hergestellt:
|
|
 |
|
1,2-Dichlorethan |
Etyhlen |
1,1-Dichlorethan C2H4Cl2 wird als Lösungs- und Extraktionsmittel für spezielle Zwecke eigesetzt. Man gewinnt es aus Vinylchlorid durch Anlagerung von HCl:
|
|
|
|
1,1 Dichlorethan |
Anlagerung des HCl nach der Regel von Markownikoff.
1,2-Dibromethan C2H4Br2, auch Ethylenbromid genannt, wird in größeren Mengen hergestellt:
|
|
|
|
1,2-Dibromethan |
Es hat den Siedepunkt 132°C und die Dichte 2,1806 g/ml (bei 20°C). Wegen seiner starken Giftigkeit darf man die Dämpfe nicht einatmen und die Flüssigkeit nicht auf die Hand bringen. Verwendung: Der Zusatz von 1,2-Dibromethan zum Benzin, dessen Klopffestigkeit durch Bleitetraethyl erhöht wurde, verhindert Bleiabscheidungen im Motor. Zu beachten ist, dass 1,2-Dibromethan die Giftigkeit des Benzins weiter erhöht.
1,1,2,2-Tetrachlorethan C2H2Cl4 (Siedepunkt 146 °C, Dichte bei 20°C: 1,597 g/ml) ist nicht brennbar, aber stark giftig, so dass es nicht als Lösungsmittel verwendet werden kann. Es ist Ausgangsstoff für das wichtige Trichlorethylen und wird deswegen in großer Menge hergestellt:
|
|
|
|
1,1,2,2-Tetrachlorethan |
Chlor und Acetylen reagieren äußerst heftig miteinander, so dass hier besondere Reaktionsbedingungen eingehalten werden müssen.
Hexachlorethan C2Cl6 bildet farblose Kristalle, die bei 185°C sublimieren. Gewinnung: Thermische Zersetzung von CCl4 bei 650°C:
|
|
|
|
Hexachlorethan |
Es hat zwei wichtige Anwendungen gefunden:
1. Ausgangsstoff für die Herstellung von Trifluor-chlor-ethylen.
2. Zur Erzeugung von künstlichem Nebel. Dazu wird Hexachlorethan mit Zn-, Mg- oder Al-Staub vermischt (Berger-Mischung). Nach der Zündung zersetzt sich die Mischung unter intensiver Rauchentwicklung.