2. Begriffsbestimmungen

2. Begriffsbestimmungen
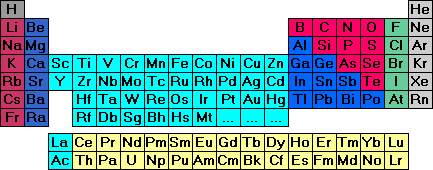
Nehmen Sie bitte ein Periodensystem, welches das Elementsymbol und den vollen Elementnamen wieder gibt, zu Hand. Bevor das "Warum" der Anordnung erläutert wird, sollen einige Begriffe erklärt werden, um Verständigungsschwierigkeiten zu vermeiden.
2.1. Zeichenerklärung
Jedes Element ist mit seinem Elementsymbol eingetragen, der volle Elementname ist klein darunter geschrieben (nicht bei jedem Periodensystem üblich) in der Absicht, das Periodensystem für einen Chemie - Neuling damit etwas durchsichtiger zu machen.
Über dem Elementsymbol ist jeweils die Kernladungszahl des Elements angegeben. Der Begriff "Kernladungszahl" ist im Programm "Atombau", Abschnitt 2.1 erklärt.
2.2. Perioden
Die Zeilen des Periodensystems weden Perioden genannt; die erste Periode z. B. wird von den beiden Elementen Wasserstoff und Helium gebildet, die zweite Periode enthält die acht Elemente von Lithium bis zum Neon, die vierte Periode enthält die 18 Elemente vom Kalium bis zum Krypton.
|
Das Periodensystem umfaßt sieben Perioden (waagerechte Zeilen), die folgende Anzahl von Elemente enthalten:
|
||||||||||||||
|
2.3. Gruppen
Die Spalten des Periodensystems werden als Gruppen bezeichnet. Beispielsweise bilden die Elemente Fluor, Chlor, Brom, Jod, Astat ein Gruppe.
2.3.1. Hauptgruppen und deren Eigenschaften

| I Alkalimetalle : | Li, | Na, | K, | Rb, | Cs, | Fr |
| II Erdalkalimatalle : | Be, | Mg, | Ca, | Sr, | Ba, | Ra |
| III Erdmetalle : | B, | Al, | Ga, | In, | Tl, | |
| IV Kohlenstoffgruppe: | C, | Si, | Ge, | Sn, | Pb | |
| V Stickstoffgruppe : | N, | P, | As, | Sb, | Wi | |
| VI Sauerstoffgruppe : | O, | S, | Se, | Te, | Po | |
| VII Halogenide : | F, | Cl, | Br, | I, | At | |
| VIII Edelgase : | He, | Ne, | Ar, | Kr, | Xe, | Rn |
Die Gruppen auf rotem, grünem, hell - dunkelblauem und grauem Untergrund sind die Hauptgruppen, insgesamt gibt es acht; die dazugehörigen Elemente werden entsprechend als Hauptgruppenelemente bezeichnet. Die oben genannten Elemente Fluor, Chlor, Brom, Jod und Astat sind alle Elemente der siebten Hauptgruppe.
Hauptgruppenelemente sind auch die beiden Elemente der ersten Periode, Wasserstoff und Helium, deren etwas abgesetzte Position im Periodensystem später noch besprochen wird.
Eigenschaften der Hauptgruppen
1.Gruppe ( Alkalimetalle)
-Sehr stark reaktionsfähige Elemente
-1 Elektron auf der äussersten Schale
-Niedriger Schmelz- und Siedepunkt und sehr weich
-Einziges Elektron auf der äussersten Schale wird sehr leicht abgegeben
-Reagieren bei Zimmertemperatur mit Luftsauerstoff
-Müssen unter Petroleum oder Paraffinöl aufbewahrt werden
-In Wasser wird Wasserstoff freigesetzt; zurück bleibt eine alkalisch Lösung
(Lauge)
2. Gruppe ( Erdalkalimetalle )
-Stark reaktionsfähige Elemente, jedoch
weniger stark als Alkalimetalle
-2 Elektronen auf der äussersten Schale
-Ihre Ione treten meistens mit der Oxidationszahl +2 auf
-In Wasser wird Wasserstoff freigesetzt; zurück bleibt eine alkalisch Lösung
(Lauge)
3. Gruppe ( Borgruppe )
-Ihre Reaktionsfähigkeit ist mässig
-3 Elektronen auf der äussersten Schale
-Ihre Ione treten meistens mit der Oxidationszahl +3 auf
4. Gruppe ( Kohlenstoffgruppe )
-Diese Elemente sind eher reaktionsträge
-4 Elektronen auf der äussersten Schale
-In Verbindungen sind diese Elemente meist 2- oder 4-wertig
-Verbindungen können durch Aufnahme oder Abgabe von Elektronen entstehen
-Uebergang metallischen zu nichtmetallische Eigenschaften
5. Gruppe ( Stickstoffgruppe )
-Eher reaktionsträge Elemente
-5 Elektronen auf der äussersten Schale
-Gegenüber Sauerstoff, Schwefel und Halogenen treten sie meisten elektropositiv
-gegenüber Wasserstoff und Metallen elektronegativ
6. Gruppe ( Chalkogene )
-stark Reaktionsfähige Elemente, jedoch
weniger stark als Halogene
-6 Elektronen auf der äussersten Schale
-Bilden Erze
-In Verbindungen kommen sie meistens elektronegativ vor
7. Gruppe ( Halogene )
-Sehr stark reaktionsfähige Elemente
-7 Elektronen auf der äussersten Schale
-Nimmt normalerweise Elektronen auf
-Salzbilder: vorallem mit Alkalimetallen
8. Gruppe ( Edelgase )
-Sie sind ausserordentlich reaktionsträge
durch die stabile Elektronenkofiguration
-8 Elektronen auf der äussersten Schale
-Farb-, geruch- und geschmacklos
-Unbrennbar und ungiftig
-Treten als einatomige Gase auf
2.3.2. Nebengruppen

Die Gruppen auf türkisem Untergrund sind die Nebengruppen des Periodensystems, insgesamt zehn; die dazugehörigen Elemente werden als Nebengruppenelemente bezeichnet oder als Übergangselemente.
z. B. : Eisen (Fe) oder Gold (Au) sind Elemente der Nebengruppen
2.3.3. Lanthaniden und Actiniden
Die beiden Elementreihen auf gelbem Untergrund, die unten separat aufgeführt sind, werden als Lanthaniden und Actiniden bezeichnet.
Die Lanthanoide und Actinoide füllen die f-Orbitale auf.Alle Lanthanoide und Actinoide sind Metalle. Außerdem sind alle Actinoide ausnahmslos radioaktiv.