 Abb.
4
Abb.
44. Periodizität einiger Eigenschaften von Hauptgruppenelementen
4. Periodizität einiger Eigenschaften von Hauptgruppenelementen
In den vorhergehenden Abschnitten ist erwähnt worden, daß die chemische Reaktivität eines Elements durch seine Elektronenkonfiguration bestimmt wird. Die Elektronenkonfiguration der Elemente ist auch das Ordnungsprinzip des Periodensystems. Folglich sollte auch ein Zusammenhang bestehen zwischen der chemischen Reaktivität eines Elements und seiner Stellung im Periodensystem.
Hier soll nicht der sehr vielschichtige Begriff " chemische Reaktivität " mit der Stellung eines Elements im Periodensystem in Beziehung gebracht werden, sondern einige relativ einfache Elementeigenschaften, die aber ihrerseits wiederum die chemische Reaktivität eines Elements beeinflussen. Es sind diese folgende Eigenschaften:
Atomradius
Ionenradius
Ionisierungsenergie
Elektronenaffinität
Diese Eigenschaften werden von der Elektronenkonfiguration der Elemente beeinflußt und ändern sich deshalb innerhalb der Perioden und Gruppen des Periodensystems auf regelmäßige Weise. Wenn man diese Regelmäßigkeiten kennt, dann kann man das Verhalten der Elemente bei manchen chemischen Reaktionen leichter verstehen oder sogar vorhersagen.
4.1. Atomradien der Hauptgruppenelemente
Eine Vorbemerkung zur Bestimmung von Atomradien:
Atome sind keine scharf begrenzten Teilchen; das ergibt sich zwingend aus der Elektronendichteverteilung in den Orbitalen, die ja die Atomhülle bilden ( siehe "Atombau" Abschnitt 3.3 ). Man kann deshalb nicht von Atomradien sprechen wie vom Radius einer Holzkugel, sondern das Volumen eines Atoms wird innerhalb gewisser Grenzen von der Umgebung des Atoms abhängen. Hat ein Atom genug freien Raum zur Verfügung, dann kann die Elektronenhülle ungehindert ihren maximalen Raumbedarf ausfüllen. Sind jedoch an allen Seiten Nachbaratome vorhanden, dann werden sich in den Grenzbereichen zwischen den Atomen die Elektronenhülle etwas behindern. Die Atomradien werden also von den Bedingungen abhängig, unter denen sie gemessen werden.
Man bestimmt die Atomradien üblicherweise aus dem Abstand zwischen den Atomkernen gleicher Atome, wenn diese Atome möglichst dicht zusammengepackt sind. Da alle Atomradien nach dieser Methode ermittelt werden, lassen sie sich auch gut miteinander vergleichen.
In Abb. 4 sind die Atomradien für die Elemente der 2. Periode und der 1. Gruppe des Periodensystems in ihrer relativen Größe maßstabgerecht dargestellt. Das achte Element der 2. Periode ist bewußt nicht aufgeführt, weil die Atomradien der Elemente der 8. Gruppe nicht unter den gleichen Bedingungen meßbar sind wie die Radien der übrigen Elemente.
 Abb.
4
Abb.
4
Abb. 4: Atomradien für die Elemente der 1. Hauptgruppe und der 2. Periode des Periodensystems
Was Abb. 4 für die Elemente der 2. Periode und der 1. Gruppe zeigt, gilt entsprechend auch für die Hauptgruppenelemente der anderen Perioden und Gruppen:
Innerhalb einer Gruppe nimmt der Atomradius von oben nach unten zu.
Dieser Trend ist zu erwarten, dann mit jeder Periode kommt eine neue Elektronenschale dazu.
Innerhalb einer Periode nimmt der Atomradius von links nach rechts ab.
Auch diese Größenänderung ist verständlich, denn innerhalb einer Periode wird das neu hinzukommende Elektron immer in die gleiche Schale eingebaut. Die Zahl der Schalen bleibt also konstant, die Kernladung nimmt aber zu und dadurch wird die Elektronenhülle näher an den Kern herangezogen. Man kann sich auch vorstellen, daß die Orbitale einer Elektronenschale unter dem Einfluß der wachsenden Anziehung durch den Atomkern etwas " schrumpfen " .
4.2. Ionenradien der Hauptgruppenelemente
Für die Bestimmung der Ionenradien gilt Ähnliches wie für die Bestimmung der Atomradien ( vgl. Abschnitt 4.1 ).
Der Begriff Ion ist erklärt im Programm " Atombau " Abschnitt 3.2.6. In der Symbolschreibweise wird ein Ion dargestellt, indem man an das Elementsymbol rechts oben die Anzahl der positiven oder negativen Ladungen schreibt, z. B. Na+ für das einfach positiv geladene Natriumion und O2- oder O-- für das zweifach negativ geladene Sauerstoffion.
In Abb. 5 sind für die Elemente der 1., 2., 6. und 7. Hauptgruppe die Radien der Ionen und zum Vergleich auch die Radien der neutralen Atome in ihrer relativen Größe maßstabgerecht dargestellt. Betrachten Sie von Abb. 5 bitte zunächst nur die linke Hälfte. Dort können Sie für die Elemente der 1. Hauptgruppe die Radien der einfach positiv geladenen Ionen und für die Elemente der 2. Hauptgruppe die Radien der zweifach positiv geladenen Ionen mit den Radien der neutralen Atome vergleichen.
Die positiven Ionen sind beträchtlich kleiner als die entsprechenden Atome.
 Abb.
5
Abb.
5
Abb. 5: Atom- und Ionenrdien für die Elemente der 1., 2., 6. und 7. Hauptgruppe des Periodensystems.
Dieser Größenunterschied ist verständlich, denn positive Ionen haben weniger Elektronen als der Kernladung entspricht. Die Elektronenhülle wird durch die im Vergleich zur Elektronenzahl größere Ladung des Atomkerns stärker zusammengezogen als in neutralen Atomen.
Der Einfluß der Kernladung wird besonders deutlich, wenn man z. B. die beiden Ionen Na+ und Mg2+ vergleicht. Beide haben die gleiche Elektronenzahl, aber Mg2+ hat eine um Eins größere Kernladung und ist deutlich kleiner als Na+.
Bei allen in Abb. 5 eingezeichneten positiven Ionen ist außerdem eine Schale weniger mit Elektronen besetzt als im entsprechenden Atom. Dadurch ist der Radius dieser Ionen verglichen mit den Atomradien noch besonders klein.
Vergleichen Sie jetzt in der rechten Hälfte von Abb. 5 für die Elemente der 7. Hauptgruppe die Radien der einfach negativ geladenen Ionen und für die Elemente der 6. Hauptgruppe die Radien der zweifach negativ geladenen Ionen mit den Radien der entsprechenden neutralen Atome.
Die negativen Ionen sind erheblich größer als die entsprechenden Atome.
Dieser Größenunteschied läßt sich damit erklären, daß bei den negativen Ionen die Elektronenhülle mehr Elektronen enthält als der Kernladung entspricht. Die Elektronenhülle wird nicht mehr so stark zusammengehalten, die gegenseitige Abstoßung der Elektronen kommt stärker zur Geltung.
Innerhalb einer Gruppe ist für die positiven und negativen Ionen die gleiche Tendenz festzustellen:
Innerhalb einer Gruppe nehmen die Radien der positiven und negativen Ionen von oben nach unten zu.
Der Grund dafür ist wie bei den Atomradien die zunehmende Zahl der Elektronenschalen.
4.3. Ionisierungsenergien der Hauptgruppenelemente
Zur Definition der Ionisierungsenergie:
Im Programm " Atombau ", Abschnitt 3.2.6 ist die Ionisierungsenergie definiert worden als die Energie, die man minestens aufwenden muß, um aus einem Atom ein Elektron zu entfernen.
Diese Definition kann man etwas anders formulieren, wenn man weiß, daß sich die Elektronen eines Atoms auf Orbitale unterschiedlicher Energie verteilen. Je höher die Energie des Orbitals ist, in dem sich das abzutrennende Elektron befindet, desto geringer ist die zur Entfernug des Elektrons notwendige Energie. Durch das Wort " mindestens " in der oben angegebenen Definition wird festgelegt, daß als Ionisierungsenergie nicht jeder Energiebetrag bezeichnet wird, der notwendig ist, um ein beliebiges Elektron aus der Elektronenhülle eines Atoms abzutrennen; es muß vielmehr das Elektron sein, das sich mit dem geringsten Energieaufwand entfernen läßt, d. h. es muß ein Elektron aus dem energiereichsten besetzten Orbital sein.
Als Ionisierungsenergie eines Atoms wird die Energie bezeichnet, die aufzuwenden ist, um ein Elektron aus dem energiereichsten besetzten Orbital zu entfernen.
Bei Hauptgruppenelementen, die hier ausschließlich besprochen werden, handelt es sich bei dem abzutrennenden Elektron also immer um ein Elektron der äußersten Schale.
Da sich die Elektronenkonfiguration der äußersten Schale in jeder Periode wiederholt, kann man vermuten, daß auch die Ionisierungsenergie der Hauptgruppenelemente eine gewisse Periodizität zeigt.
Aufgabe1:

Die Elektronenkonfiguration des ersten, zweiten, siebten und achten Elements der 2. Periode ist aufgezeichnet. Welche Voraussagen würden Sie aufgrund der Elektronenkonfiguration für die relative Größe der Ionisierungsenergien dieser Elemente machen?
Die Ionisierungsenergien
a) sind für alle vier Elemente gleich.
b) sind für alle vier Elemente verschieden.
c) von Li und Be sind gleich.
d) von F und Ne sind gleich.
e) von Be und Ne sind gleich
Anzukreuzen ist Alternative b)
Wenn Sie außer dem in diesem Programm dargelegten Stoff keine Vorkenntnisse haben, müßten sie die Alternativen c) und d) angekreuzt haben..
In Abb. 6 sind die Ionisierungsenergien der vier Elemente ( Li, Be, F und Ne ) von Aufgabe 1 in ihrer relativen Größe graphisch dargestellt.
 Abb.
6: Ionisierungsenergien der Elemente Li, Be, F und Ne.
Abb.
6: Ionisierungsenergien der Elemente Li, Be, F und Ne.
Obwohl bei Lithium und Beryllium jeweils ein Elektron aus dem 2s-Orbital abgetrennt wird, muß dazu offenbar ein unterschiedlicher Energiebetrag aufgewendet werden. Bei Fluor und Neon wird jeweils ein 2p-Elektron abgespalten, aber auch hier ist die Ionisierungsenergie verschieden.
Erklärung:
In Aufgabe 1 ist für jedes der vier Elemente ein Energieniveauschema angegeben, das auf der Energieskala keine Maßzahlen für die Energie aufweist. Ein solches Schema gibt qualitativ die relative Lage der Energieniveaus zueinander an, und nur diese relative Lage der Energieniveaus ist notwendig, wenn man sich die Elektronenkonfiguration der Elemente herleiten will. Über den Absolutwert der Energie eines bestimmten Orbitals kann man anhand eines solchen Energieniveauschemas keine Angaben machen. Würde man beispielsweise für die Elemente Fluor und Neon die Energieniveauschemate mit dem gleichen Energiemaßstab zeichnen, dann käme man in etwa zu einer Darstellung wie sie in Abb. 7 wiedergegeben ist.
 Abb.
7
Abb.
7
Abb. 7: Energieniveauschemata für die Elemente Fluor und Neon mit gleichem Energiemaßstab
Die Reihenfolge der Energieniveaus eines Elements ist erhalten geblieben. Beim Neon sind aber im Vergleich zum Fluor die Energieniveaus auf der Energieskala etwas nach unten verschoben.
Ein 2p-Elektron in einem Neonatom hat jetzt eine niedrigere Energie als ein 2p-Elektron in einem Fluoratom. Man wird dementsprechend für Neon eine höhere Ionisierungsenergie erwarten als für Fluor.
Wie am Beispiel von Fluor und Neon erläutert, gibt es für jedes Element eine eigene, für dieses Element typische Anordnung der einzelnen Energieniveaus auf der Energieskala; dementsprechend hat jedes Element seine typische Ionisierungsenergie.
 Abb.
8: Ionisierungsenergien der Hauptgruppenelemente
Abb.
8: Ionisierungsenergien der Hauptgruppenelemente
In Abb. 8 sind die Ionisierungsenergien der Hauptgruppenelemente in Abhängigkeit von der Ordnungszahl aufgetragen.
An den höchsten Spitzen der Kurve stehen die Elemente der 8. Gruppe, die sogenannten Edelgase; sie haben sehr hohe Ionisierungsenergien. An den tiefsten Punkten der Kurve stehen die Elemente der 1. Gruppe; sie haben sehr niedrige Ionisierungsenergien.
Dazwischen steigen die Ionisierungsenergien innerhalb einer Periode im allgemeinen an. Die kleinen Zacken der Kurve sollen vorläufig unbeachtet bleiben.
Wie ist die Form dieser Kurve zu erklären? Welche Faktoren beeinflussen die Energie eines Elektrons in der äußersten Schale und damit die Ionisierungsenergie?
Im folgenden werden drei Faktoren näher erläutert:
Kernladung
Atomradius
Elektronenkonfiguration
Mit Kernladung und Atomradius läßt sich die Zunahme der Ionisierungsenergie innerhalb einer Periode und die Abnahme der Ionisierungsenergie innerhalb einer Gruppe des Periodensystems verstehen:
Innerhalb einer Periode nimmt der Atomradius von links nach rechts ab ( vgl. Abb. 4 ), die Kernladung nimmt in der gleichen Richtung zu. Dadurch werden die Elektronen stärker vom positiven Atomkern angezogen und ihre Abtrennung wird erschwert.
Innerhalb einer Gruppe nimmt von oben nach unten die Kernladung auch zu, aber der Atomradius wird ebenfalls größer ( vgl. Abb. 4 ). Insgesamt resultiert eine schwache Abnahme der Ionisierungsenergie. In Abb. 8 sieht man diese Abnahme der Ionisierungsenergie innerhalb einer Gruppe recht gut bei den Edelgasen an den höchsten Spitzen der Kurve.
Die hohe Ionisierungsenergie der Edelgase läßt sich nicht nur durch Kernladung und Atomradius erklären. Hier muß man als weiteren Faktor, der die Ionisierungsenergie beeinflußt, die spezielle Elektronenkonfiguration der Edelgase hinzuziehen:
Die Edelgase haben in ihrer äußersten Elektronenschale ein voll besetztes s-Orbital und drei voll besetzte p-Orbitale, insgesamt also acht Elektronen, ein Elektronenoktett. Eine Ausnahme bildet nur das Edelgas Helium in der 1. Periode. Seine äußerste Elektronenschale ist die erste Schale, die nur ein s-Orbital enthält und mit zwei Elektronen schon voll besetzt ist.
Die Elektronenkonfiguration der Edelgase, die sogenannte Edelgaskonfiguration, stellt einen sehr energiearmen Zustand dar.
Ein Atom mit einer sehr energiearmen Elektronenkonfiguration ist sehr stabil, d. h. es ist viel Energie notwendig, um diese Elektronenkonfiguration zu zerstören. Dementsprechend ist die Ionisierungsenergie der Edelgase sehr hoch.
Die Elemente der 1. Gruppe haben alle ein Elektron mehr, als das vorhergehende Edelgas. Durch Abgabe dieses Elektrons kann ein Element der 1. Gruppe die Edelgaskonfiguration erreichen. Als Beispiel ist in Abb. 9 die Elektronenkonfiguration des Natriumatoms und des Natriumions wiedergegeben. Das Natriumion hat die Elektronenkonfiguration des Edelgases Neon; in seiner äußersten mit Elektronen besetzten Schale hat es insgesamt acht Elektronen, ein Elektronenoktett.
 Abb.
9
Abb.
9
Abb. 9: Elektronenkonfiguration des Edelgases Neon, des Elements Natrium und des Ions Na+
Weil die Elemente der 1. Gruppe beim Übergang in das einfach positiv geladene Ion Edelgaskonfiguration erreichen, haben sie eine besonders niedrige Ionisierungsenergie ( vgl. Abb. 8 )
Nun soll noch kurz auf die kleinen Zacken in der Kurve der Ionisierungsenergien eingegangen werden, die innerhalb einer Periode auftreten ( vgl. Abb. 8 )
Die kleinen Maxima treten beim zweiten und fünften Element einer Periode auf z. B. in der zweiten Periode beim Beryllium und beim Stickstoff. Die Elektronenkonfiguration in der äußersten Schale dieser beiden Elemente ist in Abb. 10 dargestellt.
 Abb.
10
Abb.
10
Abb. 10: Elektronenkonfiguration in der äußersten Schale der Elemente Beryllium und Stickstoff
Das Element der 2. Gruppe ( Be ) hat in der äußersten Elektronenschale ein vollbesetztes s-Orbital, beim Element der 5. Gruppe ( N ) sind außerdem noch alle p-Orbitale mit je einem Elektron besetzt. Offenbar sind solche ganz- oder halbbesetzte Unterniveaus energetisch besonders günstig, allerdings sind sie nicht in dem Maße energiearm wie die Edelgaskonfiguration.
Daß die Edelgaskonfiguration in der äußersten Elektronenschale ein energetisch sehr günstiger Zustand ist, soll im folgenden noch einmal deutlich gemacht werden.
Aus einem Atom kann man mit genügend großem Energieaufwand nicht nur ein Elektron entfernen, sondern auch zwei, drei und mehr. Man kann nun analog zu Abb. 8 für jedes Hauptgruppenelement die Energie auftragen, die zur Abtrennung des zweiten Elektrons notwendig ist. Man erhält dann eine sehr ähnliche Kurve wie in Abb. 8, aber die großen Maxima liegen nicht mehr bei den Edelgasen, sondern bei den Elementen der 1. Gruppe, denn deren einfach positiv geladene Ionen haben in ihrer äußersten Schale die Edelgaskonfiguration. Durch Abgabe eines zweiten Elektrons würden sie diese energetisch günstige Elektronenkonfiguration verlieren.
Entsprechend liegen die Minima dieser Kurve, die man für die Abspaltung des zweiten Elektrons erhält, bei den Elementen der 2. Gruppe, weil diese Elemente durch Abgabe eines zweiten Elektrons in ihrer äußersten Elektronenschale die Edelgaskonfiguration erreichen.
An dieser Stelle soll nur nebenbei erwähnt werden, daß die Abspaltung eines weiteren Elektrons aus einem bereits positiv geladenen Ion verständlicherweise eine wesentlich größere Energie erfordert als die Abspaltung eines Elektrons aus einem neutralen Atom.
4.4. Elektronenaffinitäten der Hauptgruppenelemente
Aus einem Atom können nicht nur Elektronen abgespalten werden, ein Atom kann auch zusätzlich Elektronen in seine Hülle aufnehmen. Aus dem neutralen Atom entsteht dabei ein negatives Ion. Bei vielen Elementen wird bei diesem Vorgang Energie frei, d. h. diese Elemente erreichen durch den Einbau eines zusätzlichen Elektrons in ihre Elektronenhülle einen energieärmeren Zustand. Bei einigen Elementen muß allerdings Energie aufgewendet werden, um ein zusätzliches Elektron in die Elektronenhülle zu bringen.
Der Energiebetrag, der frei wird oder aufgewendet werden muß, um ein zusätzliches Elektron in die Elektronenhülle eines Atoms zu bringen, wird Elektronenaffinität genannt.
Ein Element hat eine große Elektronenaffinität, wenn bei der Anlagerung eines Elektrons an das neutrale Atom viel Energie frei wird.
Ein Element hat eine kleine Elektronenaffinität, wenn bei diesem Vorgang wenig Energie frei wird oder sogar Energie aufgewendet werden muß.
Die Größe der Elektronenaffinität wird im wesentlichen von den gleichen Faktoren bestimmt, die schon bei der Ionisierungsenergie ( Abschnitt 4.3 ) besprochen worden sind:
Kernladung, Atomradius und Elektronenkonfiguration.
Hohe Kernladung und kleiner Atomradius bewirken eine starke Anziehung zwischen Atomkern und Elektron, die Folge ist eine hohe Elektronenaffinität. Die Elektronenaffinität wird außerdem sehr erhöht, wenn durch den Einbau eines weiteren Elektrons eine günstige d. h. energiearme Elektronenkonfiguration erreicht wird.
Dementsprechend findet man die höchsten Elektronenaffinitäten bei den Elementen der 7. Gruppe. Verglichen mit den anderen Elementen einer Periode haben sie einen kleinen Atomradius ( vgl. Abb. 4 ) und eine hohe Kernladung; durch den Einbau eines zusätzlichen Elektrons erreichen sie die Edelgaskonfiguration ( Abb. 11 ).
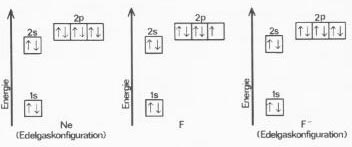 Abb.
11
Abb.
11
Abb. 11: Elektronenkonfiguration des Edelgases Neon, des Elements Fluor und des Ions F-.
Auch bei Sauerstoff und Schwefel, Elementen der 6. Gruppe wird Energie frei, wenn sie in das einfach negativ geladene Ion übergehen, allerdings schon weniger als bei den Elementen der siebten Gruppe.
Die Edelgase haben erwartungsgemäß eine sehr geringe Elektronenaffinität. Bei ihnen muß man Energie aufwenden, um ein zusätzliches Elektron in die Atomhülle zu bringen, weil dadurch die Edelgaskonfiguration verloren geht. Genaue Werte der Elektronenaffinitäten sind nur für wenige Elemente bekannt. Etwas vereinfacht kann man sagen:
Die Elektronenaffinität nimmt innerhalb einer Periode von links nach rechts zu mit dem Maximum bei den Elementen der 7. Gruppe. Innerhalb einer Gruppe nimmt sie von oben nach unten ab.
Die Unterschiede innerhalb einer Gruppe sind aber viel kleiner als innerhalb einer Periode.
Abb. 12 soll diesen Sachverhalt etwas veranschaulichen.
 Abb.
12: Elektronenaffinität im Periodensystem
Abb.
12: Elektronenaffinität im Periodensystem
Zur Bildung zweifach negativ geladener Ionen muß immer Energie aufgewendet werden, weil das zweite Elektron entgegen der elektrischen Abstoßung in ein bereits negatives Ion eingebaut werden muß. Selbst beim Sauerstoff, der mit zwei zusätzlichen Elektronen die Edelgaskonfiguration erreicht, muß Energie aufgebracht werden, um das zweite Elektron in die Atomhülle zu bringen.
Zusammenfassung der Abschnitte 4.3 und 4.4
Die Elemente links im Periodensystem haben eine niedrige Ionisierungsenergie, und eine niedrige Elektronenaffinität. Wenn es darum geht, positive oder negative Ionen zu bilden, bevorzugen sie dementsprechend die Bildung positiver Ionen.
Die Elemente rechts im Periodensystem außer den Edelgasen haben eine hohe Ionisierungsenergie und eine hohe Elektronenaffinität. Die bevorzugen dementsprechend die Bildung negativer Ionen.
Die Edelgase haben eine sehr hohe Ionisierungsenergie und eine sehr niedrige Elektronenaffinität. Sie können nur unter sehr hohem Energieaufwand in positive oder negative Ionen überführt werden.