| a) | 87,91 g FeS erfordern 55,847 g Fe |
|
| 150,0 g FeS ......................... x g Fe |
| 4.4.2 | Berechnen des Umsatzes bei reinen Stoffen |
In nachstehenden Aufgaben sind die Reaktionspartner als reine Stoffe (r.S.) aufzufassen.
|
Aufgabe 1: |
Aus Eisen Fe und Schwefel S wurde Eisen(II)-sulfid FeS hergestellt.
a) Wieviel Gramm Fe und wieviel Gramm S werden stöchiometrisch für 150,0 g FeS gebraucht?
b) Wieviel Gramm FeS entstehen aus 20,0 g Fe bei 80,0%iger Ausbeute?
|
Rechengang I über Dreisatz: |
Reaktionsgleichung: Fe + S → FeS
M(Fe) = 55,847 g/mol,
M(S) = 32,06 g/mol,
M(FeS) = 87,91 g/mol
| a) | 87,91 g FeS erfordern 55,847 g Fe |
|
| 150,0 g FeS ......................... x g Fe |
Die erforderliche Masse an Schwefel ergibt sich als Differenz 150,0 g - 95,3 g = 54,7 g ; sie könnte auch über einen Dreisatz berechnet werden.
Es werden 95,3 g Fe und 54,7 g S gebraucht.
| b) | Aus 55,847 g Fe entstehen 87,91 g FeS |
|
| .... 20,0 g Fe ............................ x g FeS |
80,0% von 31,5 g FeS sind 25,2 g FeS
|
Rechengang II über Proportionen: |
Die Aufgabe läßt sich auch über eine Proportion berechnen:
Eine
Grundgleichung der Stöchiometrie ist die Gleichung
14
![]() (S.4.1.2)
(S.4.1.2)
Daraus
![]()
In der Reaktionsgleichung Fe + S → FeS sind die Stoffmengenverhältnisse der Reaktionspartner gleich, n = 1 (die Stöchiometrischen Zahlen sind jeweils 1). Somit gilt
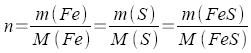
Allgemein gilt mit gleichem Stoffmengenverhältnis

a) m in Gramm
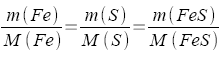
Berechnen von m(Fe) für 150,0 g FeS:
| x = m(Fe) | Mit "Kreuzprodukt" (s.13.3) |
|
|
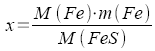 |
|
|
|
Wie im Rechengang I könnte die erforderliche Masse an Schwefel über die entsprechende Proportion berechnet werden (prüfe nach!).
b) Berechnen von m(FeS) bei 20,0 g Fe:
| x = m(Fe) | Mit "Kreuzprodukt" (s.13.3) |
|
|
|
|
|
|
Ergebnisse und Schlußsätze wie unter Rechengang I.
|
Aufgabe 2: |
Gesucht ist mit den Angaben vorstehender Aufgabe 1 die Ausbeute an FeS, bezogen auf S, wenn 13,3 g S eingesetzt wurden und 28,7 g FeS entstanden.
|
Rechengang I : |
| 32,06 g S ergeben stöchiometrisch 87,91 g FeS |
|
| 13,3 g S ................................................ x g FeS |
28,7 g FeS sind, bezogen auf 36,5 g FeS, 78,7%.
Die Ausbeute könnte auch auf eine Einwaage an Fe bezogen angegeben werden.
|
Rechengang II : |
| x = m(FeS) |
|
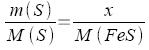 |
Ergebnisse und Schlußsätze wie unter Rechengang I.
|
Aufgabe 3: |
Als Laborpräparat wurde Acetylchlorid, Ethansäurechlorid, CH3-COCl hergestellt. Hierzu wurde wasserfreie Ethansäure ("Eisessig") CH3-COOH mit Phosphor(III)-chlorid PCl3 nach
3 CH3COOH + PCl3 → 3 CH3COCl + H3PO3
umgesetzt.
a) Wieviel Gramm "Eisessig" mußten zur Reaktion eingesetzt werden, wenn 20,0 g CH3-COCl hergestellt werden sollten und in der Arbeitsvorschrift die erzielbare Ausbeute, bezogen auf beide Ausgangsstoffe, zu 45% der Theorie angegeben ist?
b) Welche Volumina der - flüssigen - Ausgangsstoffe mußten abgemessen werden? Dichte (CH3COOH) = 1,0492 g/ml, Dichte (PCl3) = 1,574 g/ml.
|
Rechengang I : |
Mit M(CH3COOH) = 60,052 g/mol, M(PCl3) = 137,333 g/mol und M(CH3COCl) = 78,488 g/mol gilt:
a)
| 3 x 78,488 g CH3COCl erfordern 3 x 60,052 g CH3COOH |
|
| 20,0 g CH3COCl .................................... x g CH3COOH |
| 3 x 78,488 g CH3COCl erfordern 137,333 g PCl3 |
|
| 20,0 g CH3COCl ..... ........................... x g PCl3 |
Beachte: Im Ansatz müssen die Stöchiometrischen Zahlen der Partner in der Reaktionsgleichung berücksichtigt werden!
| 15,3 g CH3COOH entsprechen bei 45%iger Ausbeute |
|
| 11,7 g PCl3 ...........entsprechen bei 45%iger Ausbeute |
|
Begründe das hier umgekehrte Schlußverhältnis!
b)
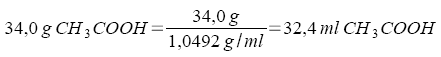

|
Rechengang II : |
a)
| x = m(CH3COOH) |
|
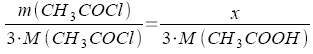 |
| y = m(PCl3) |
|
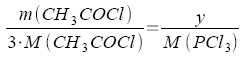 |
b)
Rechengang, Anmerkung, Ergebnisse und Schlußsätze wie unter Rechengang I.