| 12.6.2 | Berechnen der Konzentration eines schwerlöslichen Salzes, bei der eine Fällung beginnt |
|
Aufgabe: |
Eine Lösung enthält Kupfer(II)-Ionen Cu2+, Quecksilber(II)-Ionen Hg2+ und Cadmiumionen Cd2+ sowie 0,1 mol/l Wasserstoffionen H+. Wie groß muß die Konzentration der Metallionen mindestens sein, damit beim Einleiten von Wasserstoffsulfid, Schwefelwasserstoff, H2S, die Fällung der schwerlöslichen Sulfide CuS, HgS und CdS beginnen kann? In welcher Reihenfolge fallen die Sulfide aus?
L(CuS) = 10-42,
L(HgS) = 10-52,
L(CdS) = 10-27 (mol/l)2
|
Rechengang |
Beim Einleiten von Schwefelwasserstoff in eine Säure stellen sich das Lösegleichgewicht und die beiden Dissoziationsgleichgewichte des Schwefelwasserstoffs ein. Hierfür ergibt das MWG:
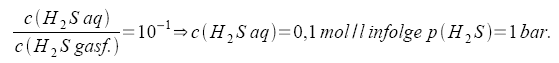
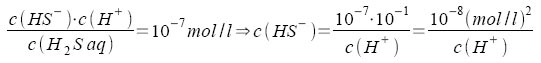
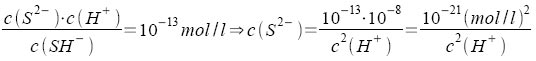
Wenn Metallsulfid als Bodenkörper vorliegt, stellt sich dessen Lösegewicht ein:
![]()
Damit eine Sulfidfällung beginnen kann, muß infolge des Verbrauches von M2+ und S2- dieses Produkt im Augenblick des Vermischens der Reaktionspartner > L sein. Da c(S2-) vorgegeben ist, gilt schließlich für die Sulfidfällung bei c(H+) = 0,1 mol/l:
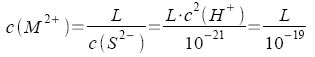
Es ergeben sich die Werte:
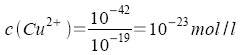
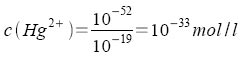
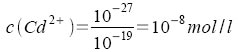
Die Sulfide fallen in der Reihenfolge HgS - CuS - CdS aus, weil die Gleichgewichte
CdS + Cu2+
![]() Cd2+ +
CuS K = 10-27
* 1042 = 1015
Cd2+ +
CuS K = 10-27
* 1042 = 1015
CdS + Hg2+
![]() Cd2+ +
HgS K = 10-27
* 1052 = 1025
Cd2+ +
HgS K = 10-27
* 1052 = 1025
CdS + Hg2+
![]() Cu2+ +
HgS K = 10-42
* 1052 = 1010
Cu2+ +
HgS K = 10-42
* 1052 = 1010
auf der rechten Seite liegen. Die angegebenen Gleichgewichtskonstanten sind (nach der Produktregel für Reaktionskombinationen) die Produkte der Konstanten des Löse- und des Fällungsvorganges.
|
Die Fällung eines Salzes beginnt erst, nachdem das Löslichkeitsprodukt erreicht ist. Dann setzen sich die Reaktionsteilnehmer im stöchiometrischen Massenverhältnis um. Die Fällung endet jedoch erst mit der Einstellung eines Gleichgewichtes zwischen dem Bodenkörper und der überstehenden Lösung. Ist an dem Fällungsvorgang eine Säure oder Base beteiligt, dann hat der pH-Wert der Lösung einen entscheidenden Einfluß auf das Gleichgewicht. |