|
|
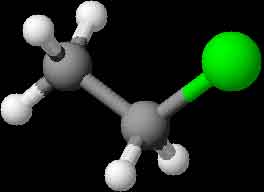 |
| Methylchlorid | Ethylchlorid |
Struktur der Halogenalkane
Strukturmodelle für Halogenalkane lassen sich unmittelbar von den Alkanen ableiten, d. h. die Vierwertigkeit des Kohlenstoffs und das Tetraedermodell für die Valenzrichtungen bestimmen auch hier die Struktur der Moleküle. Die Strukturmodelle sollen an den Chloralkanen erläutert werden.
Die Molekülmodelle des CH3Cl und des C2H5Cl zeigen diese Bilder:
|
|
 |
| Methylchlorid | Ethylchlorid |
Beim CH3Cl sind verschiedene Möglichkeiten der Substitution durch Chlor denkbar:
|
|
|
|
|
Danach müssten vier Isomere des CH3Cl auftreten. Es ist aber nur eine Verbindung CH3Cl bekannt; Isomere dazu wurden nicht gefunden. Die Begründung liegt im völlig symmetrischen Aufbau der Kohlenstoff-Valenzen im Tetraedermodell. Es ist gleichgültig, welches H-Atom durch Chlor substituiert wird. Immer entsteht die gleiche Verbindung mit entsprechend gleichen Eigenschaften und gleichem Verhalten. Damit ist gleichzeitig der Beweis erbracht, dass im Methan CH4 alle H-Atome "gleichwertig" sind.
Die Atomabstände in den Halogenalkanen zeigt die Tabelle:
| Bindung | Abstand |
| C-C | 1,54 Å |
| C-H | 1,09 Å |
| C-F | 1,42 Å |
| C-Cl | 1,76 Å |
| C-Br | 1,91 Å |
| C-J | 2,28 Å |
Am (C-C) - und (C-H)-Abstand hat sich hier gegenüber den Alkanen nichts geändert. Entsprechend der Zunahme der Atomradien der Halogene nehmen auch die Abstände dieser Elemente vom Kohlenstoff zu.
Auch beim C2H5Cl ist es gleichgültig, welcher Wasserstoff durch Chlor ersetzt wird. Isomere gibt es vom C2H5Cl nicht.
Tritt dagegen ein Cl-Atom in das Propan-Molekül ein, müssen zwei Isomere entstehen, wenn das Chlor an ein endständiges oder an das mittelständige C-Atom gebunden wird:
|
|
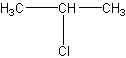 |
| 1-Chlorpropan oder n-Propylchlorid | 2-Chlorpropan oder i-Propylchlorid |
Siehe Nomenklatur der Halogenalkane!
Die Unterschiede zwischen beiden Verbindungen zeigen sich sehr deutlich auch in ihren Siedepunkten und Dichten (Siehe Physikalische Daten der Halogenalkane).
Die Zahl der Isomere steigt, wenn die Chlor-butane C4H9Cl betrachtet werden. Man unterscheidet hier primäre, sekundäre und tertiäre C-Atome, an die das Chlor gebunden ist. Entsprechend benennt man auch die Verbindungen. Es existieren folgende C4H9Cl-Isomere:
| a) primär:
|
|
|
| n-Butylchlorid, 1-Chlor-butan | i-Butylchlorid, 1-Chlor-2-methyl-propan |
In beiden Verbindungen ist das Chlor an ein primäres C-Atom gebunden, d. h. dieses C-Atom ist nur mit einem weiteren C-Atom verbunden.
| b) sekundär:
|
|
|
sekundär-Butylchlorid, 2-Chlor-butan |
Ein sekundäres C-Atom, an das hier das Chlor gebunden ist, ist mit zwei anderen C-Atomen verbunden.
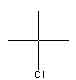
c) tertiär:
 |
|
|
tertiär Butylchlorid, 2-Chlor-2methyl-propan |
Ein tertiäres C-Atom ist mit drei anderen C-Atomen verbunden.
Primäre C-Atome sind immer endständig, sekundäre und tertiäre C-Atome immer mittelständig.
Die Reaktionsfähigkeit des Chlors wird durch seine Stellung an einem dieser C-Atome wesentlich beeinflusst.
Bislang wurden nur Verbindungen erläutert, die ein Chloratom im Molekül enthalten (Mono-halogen-alkane). Isomere treten naturgemäß auch auf, wenn mehrere Cl-Atome enthalten sind.
Beispiel: Zwei Cl-Atome im Molekül
| vom Ethan: |
|
|
||
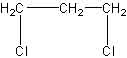
| vom Propan: |
|
|
 |
usw. |
Bei drei und mehr Cl-Atomen im Molekül erhöht sich die Zahl der Isomere entsprechend.