Alkane
Eine große Zahl organischer Verbindungen enthalten neben Kohlenstoff nur noch das Element Wasserstoff; diese Gruppe von Verbindungen nennt man daher auch Kohlenwasserstoffe. Die einfachste Klasse der Kohlenwasserstoffe sind die Alkane.
Die Bezeichnung Alkane entspricht der modernen, systematischen Bezeichnungsweise für organische Verbindungen. Vor Einführung der Bezeichnung Alkane für diese einfachste Klasse der Kohlenwasserstoffe hatten sich noch andere Namen eingebürgert, die zum Teil heute noch gebraucht werden, z. B.:
Methan - Kohlenwasserstoffe, weil von der einfachsten Verbindung der Alkane, dem Methan, alle weiteren Verbindungen dieser Reihe abgeleitet werden können.
Gesättigte - Kohlenwasserstoffe, weil in diesen Verbindungen alle Valenzen (Wertigkeiten) des Kohlenstoffs durch Bindung mit sich selbst oder mit Wasserstoff abgesättigt sind. Diese Sättigung "bis zur Grenze" führt auch zu der Bezeichnung Grenzkohlenwasserstoffe.
Paraffine, weil die Verbindungen dieser Gruppe, wie man frühzeitig erkannte, reaktionsträge sind, d. h. nur geringes Reaktionsvermögen (Affinität) gegenüber anderen Verbindungen zeigen (parum affinis = geringe Affinität).
Aliphaten, weil es sich hier um Kohlenstoff - Verbindungen handelt, deren Moleküle offene Ketten bilden. Diese Bezeichnung ist aber auch für andere Verbindungsklassen gebräuchlich, wenn eine Unterscheidung zwischen kettenförmigen (aliphatischen) und ringgeschlossenen (cyclischen) Verbindungen getroffen werden soll.
Die einfachste Verbindung der Alkane enthält nur ein C-Atom und wird Methan genannt; es hat die Formel CH4. Weitere Verbindungen entstehen, wenn nacheinander C-Atome hinzutreten, sich mit den schon vorhandenen C-Atomen verbinden, wie es für organische Verbindungen charakteristisch ist, und die noch freien Valenzen durch Wasserstoff abgesättigt werden:
CH4, C2H6, C3H8, C4H10, C5H12, C6H14...
Jedes Glied dieser Reihe ist ein Alkan - Kohlenwasserstoff. Die gesättigte Natur dieser Verbindungen lässt sich leicht überprüfen. Greifen wir die Verbindung heraus. Vier C-Atome besitzen insgesamt 16 Valenzen (Wertigkeiten). Davon werden 6 Valenzen für die Bindung der C-Atome untereinander verbraucht, da
C-C-C-C
vier C-Atome durch 3 Bindungselektronenpaare (= 6 Elektronen oder Valenzen) verbunden werden. Die restlichen 10 Valenzen werden durch Wasserstoff ersetzt, so daß die Formel C4H10 resultiert.
Jedes Glied obiger Reihe unterscheidet sich von seinem vorhergehenden und dem folgendem Nachbarn um eine CH2-Gruppe. Eine solche Reihe von Verbindungen, in der sich die Glieder jeweils um eine bestimmte Atomgruppe, meist eine CH2-Gruppe unterscheiden, nennt man eine homologe Reihe. Die einzelnen Glieder der Reihe bezeichnet man entsprechend als Homologe. Die Alkane bilden also eine homologe Reihe, die sich von dem Anfangsglied der Reihe, dem CH4, ausgehend aufbauen lässt.
Für Verbindungen homologer Reihen lässt sich immer eine allgemeine Summenformel aufstellen. Diese lautet für Alkane:
|
Alkane |
CnH2n + 2 |
Für n müssen nacheinander die Zahlen 1, 2, 3, 4... eingesetzt werden, um die einzelnen Glieder der homologen Reihe der Alkane zu erhalten:
|
n = 1: |
C1H2 * 1 + 2 |
oder |
CH4 |
Methan |
|
n = 2: |
C2H2 * 2 + 2 |
oder |
C2H6 |
Ethan |
|
n = 3: |
C3H2 * 3 + 2 |
oder |
C3H8 |
Propan |
|
n = 4: |
C4H2 * 4 + 2 |
oder |
C4H10 |
Butan |
Die Kettenlänge der Verbindungen ist nicht begrenzt; es sind bereits Alkane mit bis n = 75 C-Atomen im Laboratorium hergestellt worden.
Struktur der Alkane
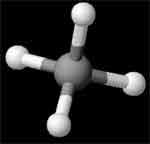
Methan
Der Aufbau des Methan-Moleküls folgt unmittelbar aus der Vierwertigkeit des Kohlenstoffs und dem Tetraedermodell für die vier Valenzen, die durch Wasserstoff ersetzt werden.
| CH4 |  |
 |
| Summenformel | Strukturformel | Kugelstäbchen-Modell |
Ein übersichtliches Modell des Methan-Moleküls erhält man, wenn die Atome durch Kugeln und die Bindungen zwischen den Atomen durch Stäbchen dargestellt werden (Kugelstäbchen-Modell). Die Stäbchen werden mit den echten Valenzwinkeln in die Kugel des Kohlenstoffs eingesetzt.
Die Winkel zwischen den Bindungen betragen 109° 28´. Der Abstand der Wasserstoffatome vom Kohlenstoff, der sogenannte (C-H)-Abstand, ist für alle gleich und beträgt 1,09 Å (1 Å = 10-8 cm).
Ethan
Das Ethan ist das zweite Glied der homologen Reihe der Alkane und enthält zwei C-Atome, die miteinander verbunden sind. Die übrigen Valenzen sind durch Wasserstoff abgesättigt.
| C2H6 oder H3C-CH3 | 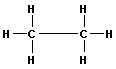 |
 |
| Summenformel | Strukturformel | Kugelstäbchen-Modell |
Bei der Aufstellung des räumlichen Modells des Ethans müssen die Valenzwinkel des C-Tetraeders erhalten bleiben.
Der Abstand der beiden C-Atome, genannt (C-C)-Abstand, beträgt 1,54 Å. Der (C-H)-Abstand ist auch hier 1,09 Å, wie er auch schon beim Methan gefunden wurde. Diese bei den einfachen Alkanen gefundenen Abstände und Bindungswinkel werden auch bei den folgenden, höheren Alkanen mit gleicher Größe angetroffen.
Propan
Auch beim Propan, das drei C-Atome enthält, und allen weiteren Alkanen müssen bei der Aufstellung von Strukturmodellen die Vierwertigkeit des Kohlenstoffs sowie die Bindungswinkel des Tetraedermodells erhalten bleiben.
|
C3H8 oder H3C-CH2-CH3 |
|
|
| Summenformel | Strukturformel | Kugelstäbchen-Modell |
Am Beispiel der rationellen Formel des Propans kann man die allgemeine Formel der Alkane CnH2n+2 ableiten, die auch für alle weiteren Glieder dieser homologen Reihe gilt. Sind mehrere C-Atome durch Bindungen miteinander verknüpft und die restlichen Valenzen mit Wasserstoff besetzt, so entstehen Verbindungen, die an den Enden der Kette je drei und allen übrigen C-Atomen je zwei H-Atome besitzen, d. h. endständige C-Atome tragen drei, mittelständige C-Atome zwei H-Atome. Auf n C-Atome kommen demnach zunächst doppelt so viel H-Atome, also 2n H-Atome, vermehrt um je ein weiteres H-Atom, das an jedem Ende der Kette zusätzlich noch gebunden ist. Daraus folgt also: n C-Atome besitzen (2n + 2) H-Atome. Damit ist die allgemeine Formel für die Alkane CnH2n+2 erklärt.
Butan
Butan besitzt vier C-Atome. Wenn man vom Propan mit drei C-Atomen ausgeht, gibt es jetzt für den Eintritt des vierten C-Atoms, um vom Propan zum Butan zu gelangen, zwei Möglichkeiten; entweder setzt sich das neue C-Atom ans Ende der Kette (a) oder es verbindet sich mit dem mittleren C-Atom, der CH2-Gruppe des Propan Moleküls (b).
| CH3-CH2-CH3 | CH3-CH2-CH3 |
| ↑ | ↑ |
| (a) | (b) |
Daraus folgen verschiedene Strukturen für das Butan-Molekül, eine gestreckte Kette (a) und eine gestreckte Kette mit Verzweigung (b). Die noch freien Valenzen werden wie üblich durch Wasserstoff besetzt:
|
|
|
|
(a) |
(b) |
In beiden Fällen ist eine CH2-Gruppe hinzugekommen. Im Falle (b) hat ein H-Atom der "mittelständigen" CH2-Gruppe die neu eintretende CH2-Gruppen ergänzt, so daß eine "endständige" CH3 Gruppe daraus wurde.
Beim Butan C4H10 tritt uns damit eine neue Erscheinung entgegen. Bei derselben Summenformel C4H10 gibt es zwei verschiedene Strukturformeln für diese Verbindung. Man nennt diese Erscheinung Isomerie. Isomere Verbindungen sind solche, die bei gleicher Summenformel verschiedene Strukturformeln besitzen und deswegen unterschiedliche chemische und physikalische Eigenschaften zeigen.
Die Verbindung des Butans mit gerader Kette (a) bezeichnet man als normal-Butan, abgekürzt n-Butan. Die isomere Verbindung dazu, das Butan mit einer "Verzweigung" an der geraden Kette (b), nennt man iso-Butan, abgekürzt i-C4H10. Für die Unterscheidung dieser beiden Strukturen spricht man allgemein von geraden und verzweigten Ketten oder auch von der Haupt- und der Seitenkette.
Während n-Butan als gestrecktes Molekül angesprochen werden kann, nähert sich i-Butan mehr einer kugeligen, gepackten Form.
|
|
|
|
n-Butan |
i-Butan |
Um eine Besonderheit zu erläutern, soll nochmals auf das Modell des n-Butans zurückgegriffen werden. Man könnte sich vorstellen, daß das Molekül nicht die dargestellte ebene Form hat, d. h. die vier C-Atome in einer Ebene liegen,
|
|
|
|
|
Freie Drehbarkeit um (C-C)-Bindung (a) |
Freie Drehbarkeit um (C-C)-Bindung (b) |
Freie Drehbarkeit um (C-C)-Bindung (c) |
sondern z.B. eine endständige CH3-Gruppe so gebunden ist, daß sie aus der Ebene heraus nach hinten in den Raum ragt.
Diese neue Struktur müsste dann ein weiteres Isomer bedingen; noch andere Isomere wären denkbar. In Wirklichkeit findet man aber nur zwei Isomere für C4H10 n-Butan und i-Butan.
Dass keine weiteren Isomere vorkommen können, lässt sich aus Bild (c) entnehmen. Eine Kohlenstoff - Kohlenstoff - Bindung besitzt nämlich freie Drehbarkeit, d. h. die CH3-Gruppe kann sich mit dem C-Atom, an das sie gebunden ist, um die Bindung drehen. Die freie Drehbarkeit von Atomen oder Atomgruppen um eine Einfachbindung, z. B. zwischen Kohlenstoff und Kohlenstoff, verhindert das Auftreten weiterer Isomere.
Höhere Alkane
Die Zahl der Isomere der nächsten Glieder der homologen Reihe, Pentan und Hexan, ist größer als beim Butan (siehe Tabelle).
|
C- Zahl der Alkane |
Zahl der Isomeren |
|
C4 |
2 |
|
C5 |
3 |
|
C6 |
5 |
|
C7 |
9 |
|
C8 |
18 |
|
C9 |
35 |
|
C10 |
75 |
|
C15 |
4347 |
|
C20 |
366319 |
Die weiteren Überlegungen sollen daher auf die normalen, gestreckten Moleküle beschränkt bleiben.
|
CH3-CH2-CH2-CH2-CH3 |
oder CH3-(CH2)3-CH3 |
CH3-(CH2)4-CH3 |
|
n-Pentan |
C5H12 |
n-Hexan C6H14 |
Für n-Pentan und n-Hexan ergeben sich folgende Modelle:
|
|
|
|
Molekülmodell des n-Pentan (a) |
Molekülmodell des n-Hexans (b) |
Die Modelle lassen erkennen, dass gestreckte Moleküle eine Zick-Zack-Form besitzen, in deren Eckpunkten die C-Atome sitzen. Die in Bild (a) dargestellte ebene Anordnung wird man infolge der freien Drehbarkeit um die (C-C)-Bindungen nur selten antreffen; den gestreckten Molekülen der normalen Alkane kommt also in Wirklichkeit mehr eine spiralige Form zu.
Für die vielen möglichen Isomere der höheren Alkane werden die Molekül-Modelle wesentlich komplizierter. Je stärker die Verzweigung ist, um so mehr nähert sich das Molekül äußerlich der Form einer Kugel.