Rutherford'sches Atommodell
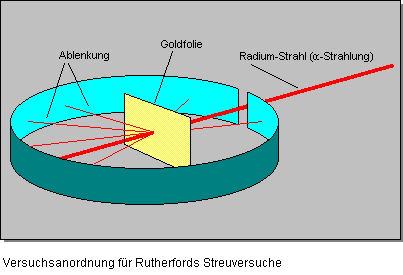
1911 veröffentliche Ernest Rutherford die Ergebnisse seiner Experimente mit alpha-Strahlen, die ihm tieferen Einblick in den Aufbau von Atomen geben sollten. In der von ihm beschriebenen speziellen Versuchsanordnung hatte er eine 0,004 mm dünne Folie aus Gold, Silber oder Kupfer mit alpha-Teilchen beschossen. Um die Folie herum hatte er einem Leuchtschirm aufgebaut, der auf alpha-Strahlen reagierte (siehe Abbildung unten). Bei diesem Experiment stellte er fest, daß der Strahl aus alpha-Teilchen fast unbeeinflußt und geradlinig durch die Folie hindurchtrat.

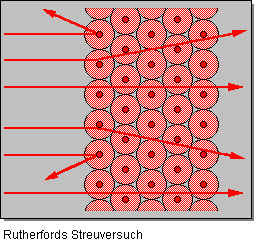
Einige alpha-Teilchen wurden jedoch abgelenkt und trafen an verschiedenen Punkten auf dem Leuchtschirm auf. Die Ergebnisse seiner Untersuchung interpretierte er folgendermaßen:
Im Mittelpunkt des Atoms befindet sich ein Atomkern. Fast die gesamte Atommasse und die ganze positive Ladung ist im Atomkern vereint. Nach unseren heutigen Vorstellungen besteht der Atomkern aus Protonen und Neutronen, die zusammen die Masse des Kerns ausmachen. Die Protonen sind für die positive Ladung verantwortlich. Trotz der gleichsinnigen Ladung der Protonen und ihrer dadurch bedingten gegenseitigen Abstoßung werden die Teilchen im Kern zusammengehalten. der Zusammenhalt wird durch die starke "Kernkraft" vermittelt. Diese ist eine der fundamentalsten Kraftwirkungen in der Natur; sie ist stärker als die elektrostatische Abstoßung zwischen den Protonen, hat aber nur eine sehr geringe Reichweite, d.h. sie wirkt nur, solange die Teilchen dicht beieinander sind.
Elektronen nehmen fast das ganze Volumen des Atoms ein. Sie befinden sich außerhalb des Atomkerns und umkreisen ihn in schneller Bewegung. Damit das Atom insgesamt elektrisch neutral ist, muß die Zahl der negativ geladenen Elektronen mit der Zahl der positiv geladenen Protonen im Kern übereinstimmen.Der Atomkern ist sehr klein, sein Durchmesser liegt in der Größenordnung von 1 x 10-15 Meter. Der Durchmesser des Atoms einschließlich der Elektronenhüllen beträgt dagegen 100 bis 400 pm (= 10-12 Meter) und ist somit mehr 100.000-mal größer als der Atomkern. Der Großteil des Volumens eines Atoms ist demnach leerer Raum, und deshalb können die meisten alpha-Teilchen ungehindert durch die Metallfolie hindurchfliegen.