
Destillieren
1. Einführung:
Die Destillation ist eine der ältesten Trennungsmethoden für flüssige resp. geschmolzene Substanzen. Dabei werden die Komponenten verdampft und der wegströmende Dampf wieder verflüssigt.

Ofen für vier Destillierblasen mit Rosenhut ( Luftkühlung) / Lit.: "Das nüv Buch der rechten Kunst zu distillieren" Srassburg 1509
Die dazu benötigten Geräte wurden im Laufe der Zeit immer weiter entwickelt. Mit modernen Destillationsanlagen sind Gemische von Substanzen trennbar, deren Siedepunkt nur Teile von Graden auseinanderliegen.
2.Allgemeine Grundlagen
2.1 Aggregatszustand
Die Teilchen ( Moleküle ) eines Stoffes werden durch gegenseitige Anziehung mehr oder weniger zusammengehalten. Von dieser Anziehung hängt es weitgehend ab, in welchem Aggregatszustand sich ein Stoff bei einer bestimmten Temperatur befindet.
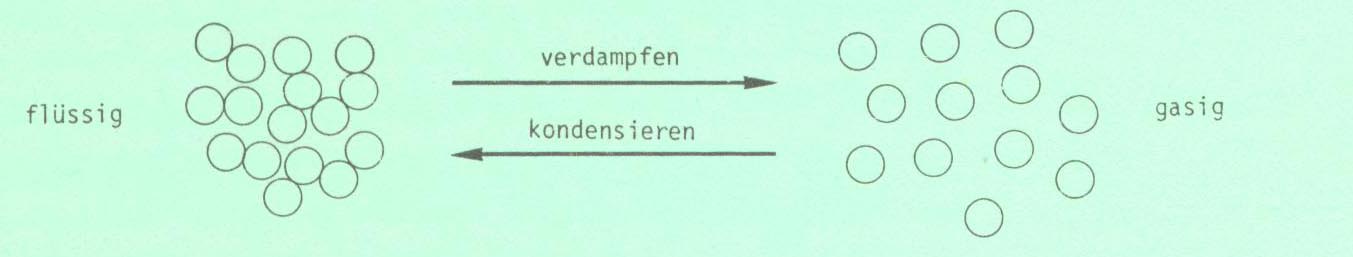
Die Destillation befasst sich mit dem Übergang : flüssig » gasig » flüssig
2.2 Verdampfen - Kondensieren
Über jeder Flüssigkeit bildet sich Dampf, aus der Flüssigkeitsoberfläche treten Moleküle in den umgebenden Raum aus. Dieser Vorgang wird als Verdampfen bezeichnet.
2.3 Dampfdruck
In einem geschlossenen System ( flüssig/gasig ) stellt sich ein temperaturabhängiger Gleichgewichtszustand ein, indem ebensoviele Teilchen pro Zeiteinheit aus der Flüssigkeit austreten, wie Dampfteilchen in diese zurückkehren.
Die sich oberhalb der Flüssigkeit befindlichen Moleküle erzeugen gegen die Umgebung ( Luftdruck, Gefässwand ) einen Druck, der als Dampfdruck der betreffenden Flüssigkeit bezeichnet wird. Der Dampfdruck ist das Mass für das Bestreben von Molekülen, aus dem flüssigen ( oder festen ) in den gasigen Aggregatszustand überzugehen.
Beim absoluten Nullpunkt ist der Dampfdruck gleich Null. Je höher die Temperatur ist, umso mehr energiereiche ( d.h. besonders schnelle ) Moleküle können pro Zeiteinheit die Flüssigkeitsoberfläche verlassen, und umso höher ist der Dampfdruck.

Der Dampfdruck von Flüssigkeiten ist temperaturabhängig.
2.4 Verdunsten
Solange der Dampfdruck einer Flüssigkeit kleiner ist als der Umgebungsdruck, treten nur Moleküle an der Oberfläche aus der Flüssigkeit aus. Dieser Vorgang wird als Verdunsten bezeichnet. Zum Verdunsten wird Wärmeenergie benötigt. Diese Verdunstungswärme wird entweder der Flüssigkeit ( wodurch sich diese abkühlt ) oder der Umgebung entzogen.
2.5 Sieden
Wird durch Temperaturerhöhung, oder durch Vermindern des Umgebungsdruckes, der Dampfdruck einer Flüssigkeit gleich gross wie der Umgebungsdruck, bilden sich im Inneren der Flüssigkeit Dampfblasen und es treten an all diesen Grenzflächen Moleküle aus. Die Flüssigkeit siedet, und es verdampft eine wesentlich grössere Menge Flüssigkeit pro Zeiteinheit als beim Verdunsten.
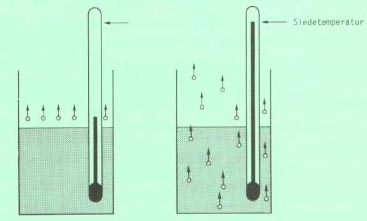
2.5.1 Siedetemperatur:
Die Siedetemperatur einer reinen Flüssigkeit ist diejenige Temperatur, bei welcher ihr Dampfdruck gleich gross wie der Umgebungsdruck ist.
Zwischen Dampfdruck, Flüchtigkeit und Siedetemperatur bestehen folgende Zusammenhänge:
- Flüssigkeiten mit tiefer Siedetemperatur sind leichtflüchtig und weisen bei Raumtemperatur meist einen hohen Dampfdruck auf.
Beispiele: Aceton, Äthylalkohol, Diethylether, Benzin
- Flüssigkeiten mit hoher Siedetemperatur sind schwerflüchtig und weisen bei Raumtemperatur meist einen tiefen Dampfdruck auf.
Beispiele: Dichlorbenzol, Glykol, Heizöl
- Die Siedetemperatur einer Flüssigkeit ist druckabhängig. Mit zunehmendem Umgebungsdruck steigt die Siedetemperatur an, mit abnehmendem Druck sinkt sie.
Faustregel: Eine Substanz siedet unter " Wasserstrahlvakuum " bei einer ca. 100°C tieferen Siedetemperatur.
Diese Druckabhängigkeit nutzt man bei hochsiedenden oder temperaturempfindlichen Substanzen, indem man durch Vermindern des Umgebungsdruckes ihre Siedetemperatur herabsetzt.
2.5.2 Siedepunkt von Wasser bei vermindertem Druck
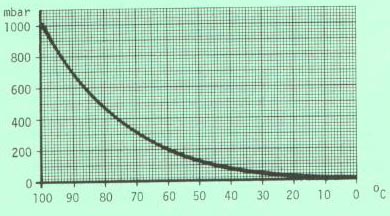
2.5.3 Tabelle zur Ermittlung der Siedetemperatur bei vermindertem Druck
Siedepunkt
bei vermindertem Druck ( 0 bis 300°C
)
Siedepunkt bei Normaldruck ( 0 bis 400 °C
)

2.5.4 Siedeverzug
Unter bestimmten Bedingungen ( langsames Erwärmen, schlechte Durchmischung ) kann eine Flüssigkeit - ohne zu Sieden - einige Grade über ihre Siedetemperatur erhitzt werden. Dabei kann die geringste Erschütterung, oder die Zugabe eines Siedeerleichterers, ein plötzliches Verdampfen auslösen. Das Sieden ist dann meistens so heftig, dass ein grosser Teil der Flüssigkeit herausspritzt.
Ein sehr ähnlicher Vorgang ist das " Stossen ". Die Dampfbläschen steigen nicht einzeln zur Flüssigkeitsoberfläche empor, sondern vereinigen sich am Boden des Gefässes zu grossen Dampfblasen, die dann plötzlich unter kräftigem " Stossen " an die Oberfläche aufsteigen. Diesen Vorgang beobachtet man häufig bei Flüssigkeiten mit Bodensatz.
Siedeverzüge lassen sich durch Rühren bzw. Schütteln der Flüssigkeit oder durch Zugabe eines Siedeerleichters vermeiden.
Als Siedeerleichter dienen:
- Siedesteine
( Reiskorn - grosse Stücke poröser Materialien ). Sie sind nur bei Normaldruck wirksam. Beim Erwärmen der Flüssigkeit entweicht durch Ausdehnung ein Teil der in den Poren eingeschlossenen Luft in Form kleiner Gasbläschen. Bei Siedetemperatur erleichtern dann die restlichen Luftpolster und die scharfen Kanten des Siedesteins die Bildung von Dampfblasen. Nach dem Abkühlen sind die Siedesteine nicht mehr wirksam. Zudem verhindert dieser Siedevorgang ( Durchmischungseffekt ) eine Überhitzung der Flüssigkeit.
- Siedekapillaren
Diese haarfeinen Glasröhrchen werden, an einem Ende verschlossen für Normaldruck, beidseitig offen bei vermindertem Druck eingesetzt. Die austretenden Luftbläschen ( bei einseitig geschlossener Kapillare durch Erwärmung, bei der offenen Kapillare durch Druckunterschied entstehend ) entsprechen der Wirkung eines Siedesteins.
2.6 Verdampfungswärme
Hat eine reine Flüssigkeit ihre Siedetemperatur erreicht, dann verdampft sie, ohne dass die Temperatur weiter ansteigt. Während des Verdampfens muss ( zur Überwindung der Anziehungskräfte der Moleküle ) der Flüssigkeit ständig Energie in Form von Wärme, der Verdampfungswärme, zugeführt werden.
2.6.1 Verdampfungsdiagramm von Wasser

2.6.2 Spezifische Verdampfungswärme
Diejenige Wärmemenge ( in kJ/kg ) die notwendig ist, um 1 kg der betreffenden Flüssigkeit bei der Siedetemperatur vom flüssigen in den gasigen Zustand überzuführen.
2.7 Hinweis
Alle Grundlagen betreffend Verdampfen und Verdampfungswärme gelten im umgekehrten Sinn auch für die Begriffe Kondensieren und Kondensationswärme.
2.8 Siedeverhalten von binären Gemischen
Der Dampfdruck eines siedenden binären Gemisches setzt sich
zusammen aus der Summe der Dampfdrücke der beiden Komponenten .
Im Siedeverhalten unterscheidet man folgende Möglichkeiten:
2.8.1 Ideale Gemische
Die Anziehungskräfte ( vorwiegend die Polarität ) zwischen gleichartigen und verschiedenen Molekülen sind gleich gross
Die einzelnen Dampfdrücke sind von der molaren Konzentration der vorgelegten Stoffe abhängig.
Der Gesamtdampfdruck eines idealen binären Gemisches setzt sich somit zusammen aus der Summe der Dampfdrücke der beiden Komponenten bei der betreffenden Temperatur multipliziert mit dem Anteil im Gemisch in Mol %.
Beispiel: Benzol / Toluol je 50 Mol %, Siedepunkt 92,2 °C
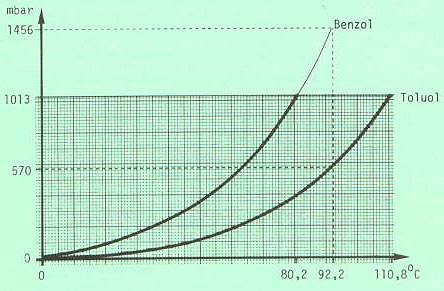
Bei der Siedetemperatur des Gemisches ( 92,2°C ) hätte Benzol theoretisch einen Dampfdruck von 1456 mbar, Toluol einen solchen von 570 mbar.
Anteil der Komponenten im Gemisch: Benzol 50 Mol %, Toluol 50 Mol %
Anteil der Dampfdrücke bei Siedetemperatur: Benzol = 1456 mbar * (50/100) = 728 mbar
Toluol = 570 mbar * (50/100) = 285 mbar
728 mbar + 285 mbar = 1013 mbar
Die Temperatur des siedenden Gemisches befindet sich zwischen den Siedetemperaturen der reinen Komponenten. Je nach Mengenverhältnis und Einzeldampfdruck liegt sie näher beim Siedepunkt der einen oder anderen Komponente. Die Siedetemperatur des Gemisches ist somit abhängig von den Konzentrationen in Mol % und den Dampfdrücken der Komponenten.
Die Zusammensetzung des Dampfes entspricht dem Dampfdruckverhältnis der beiden Komponenten; im vorherigen Beispiel: ( Benzol 728 mbar und Toluol 285 mbar ) ergibt dies eine Zusammensetzung von ca. 7 + 3 Anteilen, d. h. ca. 70 Mol % Benzol und ca. 30 Mol % Toluol bei einer Siedetemperatur von 92,2°C.
Durch das Wegdestillieren des niedersiedenden Anteils nimmt die Konzentration des schwerflüchtigen Anteils im Gemisch und somit auch die Gemisch - Siedetemperatur laufend zu.
Je weiter die Siedetemperatur bzw. Dampfdrücke der zu trennenden Komponenten auseinander liegen, umso größer ist die Anreicherung von niedersiedendem Anteil im Dampf, d. h. umso besser lässt sich ein solches Gemisch mittels Destillation trennen.
Mit Hilfe eines Gleichgewichtsdiagramm kann festgestellt werden, ob die Trennung eines idealen Gemisches durch Destillation leicht oder nur mit großem Aufwand möglich ist. Das Diagramm zeigt bei einem bestimmten Druck die Konzentrationsverhältnisse der leichtflüchtigeren Komponente im Dampf und im Gemisch:
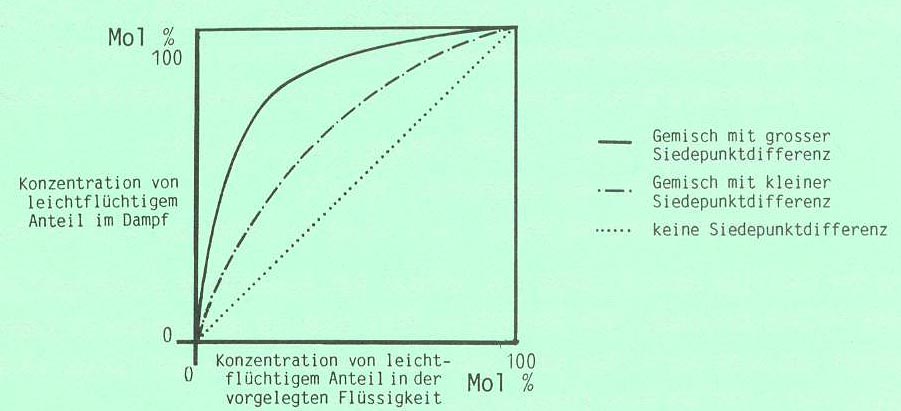
Die stark gewölbte Kurve zeigt eine gute, die schwach gewölbte Kurve eine schlechte und die Gerade gar keine Trennbarkeit des Gemisches. Die einzelnen Messpunkte der Kurve lassen sich experimentell oder mathematisch ermitteln.
2.8.2 Azeotrope Gemische
Sind die Kräfte zwischen verschiedenartigen Molekülen kleiner als zwischen gleichartigen, so entsteht ein Minimum - Azeotrop.
Der Siedepunkt des abdestillierenden azeotropen Gemisches liegt unterhalb des Siedepunktes der tiefersiedenden Komponente.
Beispiele:
Ethanol ( Sdp. 78,3°C ) / Wasser ( Sdp. 100,0°C )
Siedetemperatur des Gemisches: 78,2°C
Zusammensetzung im Dampf: 95,6 % Ethanol + 4,4 % Wasser
Toluol ( Sdp. 110,8°C ) / Wasser ( Sdp. 100°C )
Siedetemperatur des Gemisches: 85,0°C
Zusammensetzung im Dampf*: 79,8 % Toluol + 20,2 % Wasser
* Nach dem Kondensieren sind die beiden Komponenten nicht mehr mischbar.
Zusammensetzung im Kondensat: 99,95 % Toluol + 0,05 % Wasser
Sind die Kräfte zwischen verschiedenartigen Molekülen grösser als zwischen gleichartigen, so entsteht ein Maximum - Azeotrop.
Beispiele:
Chlorwasserstoff ( Sdp. -85°C ) / Wasser ( Sdp. 100,0°C ) -> Salzsäurelösung
Siedetemperatur des Gemisches: 108,6°C
Zusammensetzung im Dampf: 20,2 % Chlorwasserstoff + 79,8 % Wasser
Cyclohexanol ( Sdp. 160,0°C ) / Phenol ( Sdp. 182,2°C )
Siedetemperatur des Gemisches: 183,0°C
Zusammensetzung im Dampf: 13,0 % Cyclohexanol + 87,0 % Phenol
Azeotrope Gemische destillieren als Gemisch bei konstantem Siedepunkt mit konstanter Zusammensetzung. Die Anteile in Mol % sind im Gemisch und im Dampf gleich. Azeotrope Gemische verhalten sich somit wie reine Stoffe und lassen sich durch Destillation nicht in ihre Komponenten zerlegen.
Die Zusammensetzung des Gesamtdampfdruckes bleibt konstant und ist nicht abhängig von der Konzentration der vorgelegten Komponente, da je nach dem zuerst das Azeotrop oder die überschüssige Komponente abdestilliert.
Beispiel: Salzsäure 15 %
Beim Destillieren wird zuerst Wasser abdestilliert bis die Konzentration auf 20,2 % HCl gestiegen ist. ( siehe auch: Destillation azeotroper Gemische )