 Abb.
1 ( siehe Atombau)
Abb.
1 ( siehe Atombau)Aufbau des Periodensystems
3. Aufbau des Periodensystems
3.1. Kernladungszahl der Elemente
Liest man das Periodensystem zeilenweise, dann sind die Elemente nach steigender Kernladungszahl angeordnet; die Kernladungszahl wird deshalb auch Ordnungszahl genannt.
Aufgrund der Ordnungszahlen allein läßt sich allerdings die spezielle Form des Periodensystems nicht verstehen:
Wodurch wird z. B. die Länge der einzelnen Perioden bestimmt?
Warum gibt es Haupt- und Nebengruppenelemente?
Zur Beantwortung dieser Fragen muß man andere Kriterien als die Ordnungszahl der Elemente heranziehen.
3.2. Ähnlichkeit der Elemente
In der historischen Entwicklung des Periodensystems ergab sich die Länge der Perioden aus der auffälligen Ähnlichkeit im Verhalten einiger Elemente:
Elemente mit ähnlichen chemischen Eigenschaften wurden in einer Gruppe zusammengefaßt.
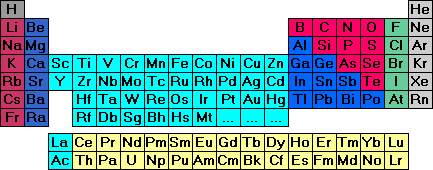
So sind etwa alle Elemente der achten Hauptgruppe am rechten Rand des Periodensystems äußerst reaktionsträge Gase. Die Elemente der ersten Hauptgruppe am linken Rand sind sehr reaktive Metalle.
Was sind nun " chemische Eigenschaften ", was heißt " reaktiv " ?
An dieser Stelle kann nur kurz auf dieses komplexe Thema eingegangen werden, für eine ausführlichere Besprechung fehlen noch die Voraussetzungen.
Das chemische Verhalten von Elementen wird entscheidend durch die Elektronen in den äußersten Elektronenschalen bestimmt, für Hauptgruppenelemente ist sogar nur die äußerste Elektronenschale von Bedeutung. Ein Element kann beispielsweise in eine chemische Reaktion eintreten, indem es eines seiner äußersten Elektronen an ein anderes Element abgibt, oder indem es von einem anderen Element ein Elektron bei sich einbaut. Ein Element, das " gerne " solche Veränderungen in seiner Elektronenhülle vornimmt, ist chemisch reaktiv; ein Element, das mit seinem ursprünglichen elektronischen Zustand sehr " zufrieden " ist und ihn durchaus nicht ändern will, ist reaktionsträge. Die " Zufriedenheit" eines Elements mit der Struktur seiner äußersten Elektronenschale richtet sich nach seiner Elektronenkonfiguration, d. h. nach Zahl, Anordnung und Energie der Elektronen.
Wenn die chemische Reaktivität der Elemente ein Kriterium für die Aufstellung des Periodensystems sein konnte, muß auch ein Zusammenhang bestehen zwischen der Struktur des Periodensystems und der Elektronenkonfiguration der Elemente.
Zusammenfassung der Abschnitte 3.1 und 3.2:
Bei der historischen Entwicklung des Periodensystems hat das chemische Verhalten der Elemente eine große Rolle gespielt: Die Elemente wurden mit steigender Kernladungszahl so angeordnet, daß chemisch ähnliche Elemente in einer Gruppe des Periodensystems standen.
Die chemische Reaktivität steht im Zusammenhang mit der Elektronenkonfiguration der Elemente. Es ist also naheliegend, daß die Elektronenkonfiguration der Elemente den Schlüssel zum Periodensystem liefern wird.
3.3. Elektronenkonfiguration der Elemente:
3.3.1 Energieniveaus der Elektronenhülle
 Abb.
1 ( siehe Atombau)
Abb.
1 ( siehe Atombau)
Diese Abbildung zeigt ein Energieniveauschema der Elektronenhülle in Kästchendarstellung wie es bereits im Programm "Atombau", Abschnitt 3.4, Abb.12, besprochen worden ist. Dort waren die Energieniveaus der ersten vier Elektronenschalen eingezeichnet, in Abb. 1 sind alle Energieniveaus erfaßt, die auf der Energieskala unterhalb des 7p-Niveaus liegen; das 7p-Niveau selbst ist das energiereichste Niveau der Abbildung. Um die Zugehörigkeit der einzelnen Energieniveaus zu einer bestimmten Schale deutlicher zu machen, sind in Abb. 1 wieder die einzelnen Schalen abwechselnd schraffiert und nicht schraffiert.
Neu in Abb. 1 sind die waagrechten grauen Bänder. Sie markieren auf der Energieskala schmale Bereiche, in denen Energieniveaus relativ eng beieinanderliegen. Zwischen den Energieniveaus innerhalb eines Bandes ist der Energieunterschied wesentlich geringer als zwischen Energie- niveaus, die zu verschiedenen Bändern gehören. Vergleichen Sie beispielsweise den Energieunterschied zwischen dem 2s- und dem 2p-Niveau mit dem Energieunterschied zwischen dem 2p- und dem 3s-Niveau.
Es ist aber keinesfalls immer so, daß die Bänder der Schalengliederung der Elektronenhülle entsprechen. Während die zu einer Schale gehörenden s- und p-Niveaus immer sehr nahe beieinanderliegen, so daß sich diese Niveaus immer innerhalb eines Bandes befinden, laufen die d- und f-Niveaus gewissermaßen davon: Das 3d-Niveau z. B. liegt viel näher bei dem 4s- und 4p-Niveau als bei dem 3s- und 3p-Niveau. Das 4f-Niveau liegt sogar schon ganz nahe am 6s-Niveau.
Um im folgenden Verwirrung zu vermeiden, ist es sehr wichtig, ganz genau zwischen den in Abb. 1 eingezeichneten Bändern und den Elektronenschalen zu unterscheiden!
3.3.2. Aufbauprinzip der einzelnen Perioden
Was hat das Energieniveauschema von Abb. 1 mit dem Periodensystem zu tun?
Aus Abb. 1 läßt sich das Aufbauprinzip des Periodensystems ablesen; dabei sollen die grauen Bänder als Hilfslinien dienen:
Man schreibt sich der Reihe nach die Elektronenkonfiguration aller Elemente auf in der Reihenfolge, wie die Elemente im Periodensystem stehen, also geordnet nach steigender Kernladungszahl. Immer wenn alle Orbitale eines Bandes voll mit Elektronen besetzt sind, ist eine Periode abgeschlossen.
Dieses Aufbauprinzip soll nun im einzelnen etwas erläutert werden.
1.Periode
Bei den beiden Elementen der 1. Periode, Wasserstoff und Helium, wird das 1s-Orbital im untersten Band der Abb. 1 zunächst mit einem, dann mit zwei Elektronen besetzt.
Am Ende der 1. Periode ist die 1. Elektronenschale voll besetzt.
2. Periode
1. Drucken Sie sich bitte die graue Übungsvorlage aus!
2. Zeichnen Sie bitte die Elektronenkonfiguration für die Elemente der 2. Periode in die leeren Energieniveaudiagramme ein.
Beim letzten Element der 2. Periode sind also alle vier Orbitale im 2. Band von Abb. 1 mit insgesamt acht Elektronen gefüllt.
Mit dem Ende der 2. Periode ist auch die 2. Elektronenschale mit der maximalen Zahl von acht Elektronen voll besetzt.
3. Periode
Ganz entsprechend geht es bei den acht Elementen der 3. Periode weiter. Die insgesamt vier Orbitale des 3. Bandes, ein 3s- und drei 3p-Orbitale, sind beim letzten Element der 3. Periode, Argon, jeweils mit zwei Elektronen gefüllt.
Mit diesen acht Elektronen ist aber die 3. Elektronenschale noch nicht mit der maximalen Zahl von Elektronen besetzt. Die d-Orbitale der 3. Schale liegen energetisch so hoch, daß sie vorläufig noch unbesetzt bleiben.
4. Periode
In der 4. Periode stehen außer den Hauptgruppenelementen zum erstenmal auch Nebengruppenelemente. Bei diesen zehn Elementen werden die d-Orbitale der 3. Schale mit Elektronen aufgefüllt. Beim Element Zink sind alle 3d-Orbitale doppelt besetzt.
Die 3. Elektronenschale enthält jetzt die maximale Zahl von Elektronen.
Beim Element Krypton, dem letzten Element der 4. Periode, sind dann auch alle 4p-Orbitale doppelt besetzt und damit alle Orbitale des 4. Bandes.
Am Ende der 4. Periode sind die d- und f-Orbitale der 4. Elektronenschale noch unbesetzt.
5. Periode
Bei den Elementen der 5. Periode werden die Orbitale des 5. Bandes aufgefüllt, ganz analog wie bei der vierten Periode beschrieben.
Beim Element Xenon, dem letzten Element der 5. Periode, ist die 5. Elektronenschale mit acht Elektronen besetzt; sie befinden sich in den 5s- und 5p-Orbitalen. Von der 4. Elektronenschale sind die d-Orbitale aufgefüllt, unbesetzt sind von der 4. Schale die f-Orbitale
6. und 7. Periode
Zur 6. Periode gehören die Lanthaniden, zur 7. Periode die Actiniden, die hier nur der Vollständigkeit halber erwähnt werden. Anhand von Abb.1 läßt sich die Stellung dieser Elementreihen im Periodensystem leicht erklären. Man braucht nur die Energieniveaus im 6. und 7. Band entsprechend ihrem Energieinhalt der Reihe nach zu besetzen, in der 6. Periode z. B. :
zuerst das 6s-Orbital bei den beiden Hauptgruppenelementen Cäsium und Barium,
dann die sieben 4f-Orbitale bei den 14 Lanthaniden,
dann die fünf 5d-Orbitale bei den 10 Nebengruppenelementen,
dann die drei 6p-Orbitale bei den sechs Hauptgruppenelementen, mit den Ordnungszahlen 81 bis 86.
Wen es beunruhigt, dass die Lanthaniden und Actiniden im Periodensystem jeweils erst nach dem dritten Element der Periode eingereiht werden und nicht nach dem zweiten, wie es aufgrund des oben Gesagten zu erwarten wäre, kann den folgenden Abschnitt lesen.
Bei den Elementen mit höherer Ordnungszahl ist die Elektronenkonfiguration oft etwas umstritten, weil sich die Energieniveaus auf der Energieskala relativ zueinander etwas verschieben, wenn schon viele Elektronen eingefüllt sind. Beim Element Lanthan z. B. müssen drei Elektronen im sechsten Band von Abb. 1 untergebracht werden. Zwei davon sitzen mit Sicherheit im 6s-Orbital, das dritte sitzt sehr wahrscheinlich in einem 5d-Orbital. Bei den nächsten Elementen mit den Ordnungszahlen 58 bis 71 werden dann die sieben 4f-Orbitale erst vollkommen aufgefüllt, bevor beim Element mit der Ordnungszahl 72 die 5d-Orbitale weiter besetzt werden.
Zusammenfassung der Abschnitte 3.3.1 und 3.3.2
Das Aufbauprinzip des Periodensystems läßt sich aus dem Energieniveauschema der Elektronenhülle ( Abb. 1 ) sehr einfach ablesen:
Die Energieniveaus der Elektronenhülle lassen sich in mehrere Bänder einordnen, so daß die Energieunterschiede zwischen den Niveaus eines Bandes wesentlich kleiner sind als zwischen den Niveaus von verschiedenen Bändern.
Innerhalb einer Periode des Periodensystems werden die Energieniveaus eines Bandes in der Reihenfolge zunehmender Energie mit Elektronen aufgefüllt.
3.3.3. Elektronenkonfiguration von Haupt- und Nebengruppenelementen
In Abschnitt 3.3.2 stand die Gliederung des Periodensystems in Perioden sehr im Vordergrund: Das Aufbauprinzip wurde dargestellt, indem für die einzelnen Perioden die Elektronenkonfiguration der darin enthaltenen Elemente beschrieben wurde.
Im folgenden soll die Gliederung der Elemente in Haupt- und
Nebengruppenelemente im Vordergrund stehen. Grundsätzlich neue Informationen
werden nicht gebracht; das bis jetzt Bekannte wird lediglich von einem anderen
Standpunkt aus betrachtet.
Hauptgruppenelemente
Zur Erinnerung: Hauptgruppenelemente sind alle Elemente, die in dem Periodensystem auf grauem, rotem, blauen und grünem Untergrund stehen.
Bei den Hauptgruppenelementen einer Periode werden nacheinander das s-Orbital und die drei p-Orbitale aufgefüllt, deren Nummer der Periodennummer entspricht. Diese Elektronenschale ist gleichzeitig die äußerste überhaupt mit Elektronen besetzte Schale.
Bei den Elementen der 3. Periode z. B. werden die s- und p-Orbitale der 3. Elektronenschale besetzt. Entsprechend der maximalen Zahl von s- und p-Elektronen pro Schale gibt es mit Ausnahme der 1. Periode in jeder Periode 8 Hauptgruppenelemente.
Die äußerste mit Elektronen besetzte Schale enthält nie mehr als 8 Elektronen.
Die Elemente mit acht Elektronen in der äußersten mit Elektronen besetzten Schale, einem sogenannten Elektronenoktett, stehen in der 8. Hauptgruppe, am rechten Rand des Periodensystems.
Von den inneren Schalen der Hauptgruppenelemente sind die s- und p-Orbitale alle voll besetzt. Die d-Orbitale dieser inneren Schale sind entweder ganz leer oder vollständig besetzt.
In Abb. 2 ist als Beispiel für das im vorhergehenden Gesagte die Elektronenkonfiguration der Hauptgruppenelemente Calcium und Brom wiedergegeben.
 Abb.
2: Elektronenkonfiguration der Elemente Calcium und Brom
Abb.
2: Elektronenkonfiguration der Elemente Calcium und Brom
Beide Elemente stehen in der 4. Periode.
Die äußerste mit Elektronen besetzte Schale ist bei beiden Elementen die Schale Nr. 4
Beim Calcium enthält die vierte Schale zwei Elektronen, beim Brom 7 Elektronen.
Von den inneren Schalen sind beim Calcium die erste und zweite voll besetzt, von der dritten Schale sind die d-Orbitale noch frei; beim Brom sind die 3d-Orbitale voll besetzt.
Nebengruppenelemente

Zur Erinnerung: Die Nebengruppenelemente stehen in dem Periodensystem auf türkisem Untergrund.
Bei den Nebengruppenelementen werden die d-Orbitale der zweitäußersten Elektronenschale mit Elektronen aufgefüllt. Die äußerste Elektronenschale, deren Nummer der Periodennummer des Elements entspricht, enthält nur s-Elektronen.
Entsprechend der Zahl der d-Orbitale pro Schale gibt es in der vierten Periode und in den höheren Perioden jeweils 10 Nebengruppenelemente.
z. B. Eisen
Eisen ist ein Element der 4. Periode. Wie bei allen Nebengruppenelementen dieser Periode werden die 3d-Orbitale mit Elektronen aufgefüllt. Beim Eisen beispielsweise sind die 3d-Orbitale mit 6 Elektronen teilweise besetzt.
In der äußersten mit Elektronen besetzten Schale befinden sich beim Eisen wie bei allen Nebengruppenelementen Elektronen nur im s-Orbital.
Lanthaniden und Actiniden
Der Vollständigkeit wegen soll erwähnt werden, daß bei diesen beiden Elementreihen die f-Orbitale der drittäußersten Elektronenschale mit Elektronen aufgefüllt werden.
3.3.4. Elektronenkonfiguration in den Hauptgruppen
In diesem Abschnitt soll die Gliederung des Periodensystems in Gruppen im Vordergrund stehen. Dieses Thema wurde bisher noch nicht ausführlich genug behandelt. Wie schon im Abschnitt 3.3.3 werden keine grundsätzlich neuen Informationen gebracht, sondern bereits Bekanntes nur eingehender dargelegt.
In Abb. 3 ist die Elektronenkonfiguration von drei Elementen der 5. Gruppe dargestellt.
 Abb.
3
Abb.
3
Abb. 3: Elektronenkonfiguration der Elemente Stickstoff, Phosphor und Arsen
Wie für Hauptgruppenelemente zu erwarten, sind unvollständig besetzte Unterniveaus bei jedem Element nur in der äußersten Elektronenschale zu finden. Alle drei Elemente haben in ihrer äußersten Schale 5 Elektronen, zwei davon im s-Orbital, je eins in den drei p-Orbitalen.
Verallgemeinert für alle acht Hauptgruppen läßt sich feststellen:
Alle Elemente einer Hauptgruppe haben in ihrer äußersten mit Elektronen besetzten Schale die gleiche Elektronenkonfiguration. Die Elektronenzahl in der äußersten Schale entspricht der Gruppennummer.
Eine Ausnahme davon stellt nur das Element Helium dar. Die äußerste mit Elektronen besetzte Schale des Heliums ist die erste Elektronenschale, die mit zwei Elektronen voll besetzt ist. Trotzdem wird Helium der achten Hauptgruppe zugeordnet.
Der wesentliche Unterschied zwischen Elementen verschiedener Hauptgruppen besteht also in der Elektronenkonfiguration der äußersten Schale. Man gibt deshalb oft nur die Elektronenkonfiguration dieser Schale an, wenn man Elemente vergleichen will, die zu verschiedenen Hauptgruppen gehören.
Im Rahmen dieses Programms soll auf die Nebengruppen nicht mehr ausführlicher eingegangen werden. Was in den bisherigen Abschnitten über Nebengruppenelemente gesagt wurde, reicht für das Verständnis der späteren Abschnitte aus.
Zusammenfassung des Abschnitts 3
Bei der Beschreibung des Periodensystems wurden drei Kriterien genannt, die bei der Einordnung der Elemente von Bedeutung sind oder die bei der historischen Entwicklung des Periodensystems eine Rolle gespielt haben, nämlich:
die Kernladung der Elemente,
die Ähnlichkeit der Elemente im chemischen Verhalten,
die Elektronenkonfiguration der Elemente.
Diese drei Kriterien sind nicht unabhängig voneinander. Von der Kernladungszahl hängt die Zahl der Elektronen und damit auch die Elektronenkonfiguration ab. Die Elektronenkonfiguration wiederum beeinflußt das chemische Verhalten der Elemente.
Für Hauptgruppenelemente kann man den letzten Satz noch präzisieren: Die chemischen Eigenschaften dieser Elemente werden im wesentlichen nur durch die Elektronenkonfiguration der äußersten Elektronenschale bestimmt. Da die Elemente einer Hauptgruppe in der äußersten Schale alle die gleiche Elektronenkonfiguration besitzen, ist es verständlich, daß diese Elemente sich chemisch ähnlich verhalten.