 als Faktor.
als Faktor.| 5.1.2.5 | Herstellen wäßriger Lösungen bei Einwaagen kristallwasserhaltiger Stoffe |
Zahlreiche Stoffe, insbesondere Salze, kristallisieren aus wäßriger Lösung als "Hydrate" mit Kristallwasser. Ist man zum Herstellen von Lösungen auf Hydrate angewiesen, so ist zu berücksichtigen: Die Einwaage setzt sich aus zwei Anteilen zusammen:
1. dem Kristallwasser - in Lösung dem "Lösemittel - Wasser" zuzuzählen,
2. dem wasserfreien Stoff - gilt in Lösung als gelöster reiner Stoff (r.S.).
Das Massenverhältnis der beiden Anteile ergibt sich aus einer stöchiometrischen Rechnung.
|
Aufgabe: |
Wieviel Gramm "Kristallsoda", Natriumcarbonat-10-hydrat Na2CO3*10H2O, müssen zum Herstellen von 750 g 5%iger Natriumcarbonatlösung eingewogen werden?
|
Rechengang: |
Soll eine Lösung aus einem kristallwasserhaltigen Stoff, einem Hydrat, hergestellt werden, dann ist eine gegenüber dem wasserfreien Stoff größere Masse einzuwägen.
Größer um das Verhältnis
 als Faktor.
als Faktor.
I Damit ist nach 21)
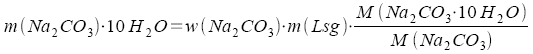
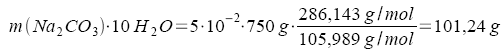
II
1.
| 100 g 5%ige Lösung enthalten 5 g Na2CO3 (r.S. wasserfrei) |
 |
| 750 g.........................................x g ....................................... |
2.

Die Einwaage muß 101,24 g Na2CO3 * 10H2O betragen.
Die Lösung enthält 37,5 g Na2CO3 (r.S.-wasserfrei) und 750 g - 37,5 g = 712,5 g Wasser.
Die Masse an Wasser setzt sich zusammen aus dem Anteil des eingewogenen Kristallwassers (101,24 g - 37,5 g = 63,74 g) und dem Anteil des "Lösemittels-Wassers".