| 4.2.5.2 | Berechnen der Empirischen Formel einer Verbindung |
|
Aufgabe: |
Berechne die Empirische Formel einer Verbindung folgender Zusammensetzung. Massenanteile: Kalium w(K) = 28,22%, Chlor w(Cl) = 25,59%, Sauerstoff w(O) = 46,19%
|
Rechengang |
100,00 g der Verbindung enthalten 28,22 g K, 25,59 g Cl und 46,19 g O.
1.
Berechnen der Stoffmengenverhältnisse (molaren Verhältnisse) der Elemente in der Verbindung.
Aus der Grundgleichung 14 (s.
4.1.2)
![]() folgt durch Umstellen
folgt durch Umstellen
![]() und damit
und damit
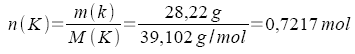
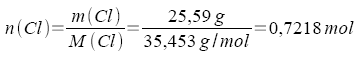
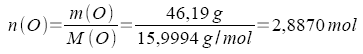
2.
Um zum kleinstmöglichen ganzzahligen Verhältnis zu kommen, werden alle Zahlen durch die kleinste vorkommende Zahl - hier 0,7217 - dividiert.
Stoffmengenverhältnis:
| 0,7217 mol K : 0,7217 | = | 1 mol K | K : Cl : O = 1 : 1 : 4 |
| 0,7218 mol Cl : 0,7217 | = | 1 mol Cl | |
| 2,9970 mol O : 0,7217 | = | 4 mol O |
Die Empirische Formel der Verbindung ist KClO4.
Beachte: Die Ergebnisse quantitativer Analysen, die Massenanteile der Atomarten in der Verbindung, enthalten Analysenfehler. Daraus ergeben sich beim Berechnen der Empirischen Formel für das Atomverhältnis Abweichungen von ganzen Zahlen, z. B. 0,97 oder 1,02. Hier wird dann die ganze Zahl, also 1, eingesetzt.
Ergibt die Berechnung ein Atomverhältnis wie z. B. 1 : 1,5 : 2, so sind zum Umwandeln in ganze Zahlen alle Werte mit 2 zu multiplizieren, das Atomverhältnis wäre dann 2 : 3 : 4.