| 4.1.2.4 | Molare Masse von Ionen |
Die Masse eines einatomigen Ions unterscheidet sich von der Masse des Atoms, aus dem es entstanden ist, durch die Masse der abgegebenen bzw. aufgenommenen Elektronen.
Beispiele:
| Symbole | |||
| 1 Natrium - Atom | → | 1 Natrium - Ion + 1 Elektron | Na → Na+ + 1 e- |
| 1 Chlor - Atom + 1 Elektron | → | 1 Chlorid - Ion | Cl + 1 e- → Cl- |
Die Masse eines Elektrons beträgt
![]() der Masse eines
Wasserstoff - Atoms (Meßwert).
der Masse eines
Wasserstoff - Atoms (Meßwert).
Damit ist die Molare Masse des Elektrons:
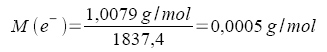
Beispiele für Molare Massen von Ionen:
|
M (Pb) |
= |
207,2 |
|
M (Pb2+) |
= |
M(Pb) - 2 M (e-) |
|
|
= |
207,2 |
|
|
- |
0,001 |
|
|
= |
207,2 |
|
M (S) |
= |
32,06 |
|
M (S2-) |
= |
M(S) - 2 M (e-) |
|
|
= |
32,06 |
|
|
+ |
0,001 |
|
|
= |
32,06 |
|
M (Br) |
= |
79,904 |
|
M (Br-) |
= |
M(Br) - M (e-) |
|
|
= |
79,904 |
|
|
+ |
0,0005 |
|
|
= |
79,905 |
|
M (H) |
= |
1,0079 |
|
M (H+) |
= |
M(H) - M (e-) |
|
|
= |
1,0079 |
|
|
- |
0,0005 |
|
|
= |
1,0074 |
|
M (P) |
= |
30,97376 |
|
M (P5+) |
= |
M(P) - 5 M (e-) |
|
|
= |
30,97376 |
|
|
- |
0,0025 |
|
|
= |
30,9713 |
|
M (F) |
= |
18,998403 |
| M (F-) | = | M(F) - M (e-) |
| = | 18,998403 | |
| + | 0,0005 | |
| = | 18,9979 |
Beachte 2.1!
Die Ergebnisse der Beispiele zeigen: Bei Ionen von Elementen, deren Molare Masse
1. nur auf wenige Dezimalstellen genau gemessen werden kann, ist M (Ion) ≈ M (Element)
2. auf weitere Dezimalstellen genau gemessen werden kann, weicht M (Ion) von M (Element) z. T. nicht unerheblich ab. Bei genauen Berechnungen ist das zu berücksichtigen.
In der allgemeinen Rechenpraxis wird die Molare Masse von Ionen vereinfachend der Molaren Masse des Atoms oder der Atomgruppe, aus der es entstanden ist, gleichgesetzt.
Daher in Handbüchern Ionen - kurz - ohne Angabe der e- - Ladung, z. B. NO3 statt NO3-, SO4 statt SO42- ...