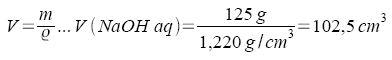
| 3.1.2 | Umrechnen Masse ↔Volumen über die Dichte |
Durch Umstellen der Gleichung 5 lassen sich bei bekannter Dichte
| 1. die Masse | einer Stoffportion |
| 2. das Volumen |
berechnen.
Stoffportion: Abgemessene Menge von Stoffen, Substanzen - Massen oder Volumina -, z. B.:
50 g Schwefelsäure
15 kg Eisen (-späne)
35 ml Wasserstoffgas bei 25 °C und 1013 hPa
1,2 l einer Wasser - Ethanol - Mischung mit 80% Ethanol
Eine weitere Angabe für eine Stoffportion ist deren Stoffmenge n in der Basiseinheit Mol (1 mol) (s.4)
|
Aufgabe: |
| Gegeben: | Masse einer Natronlauge - Portion: | m (NaOH aq) = 125 g |
| Dichte dieser Natronlauge: | ρ (NaOH aq, 20°C) = 1,220 g/cm3 | |
| Gesucht: | Volumen dieser Natronlauge - Portion: | V (NaOH aq) |
|
Rechengang |
Gleichung 5 wird nach der gesuchten Größe entwickelt. Einsetzen der Werte.
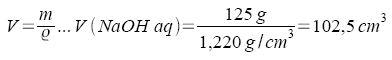
|
Aufgabe: |
| Gegeben: |
|
| Gesucht: |
Volumen V |
|
Rechengang |
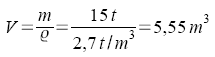
Die Einheit von
![]() wurde hier bei
Beibehaltung des Zahlenwertes für einen unkomplizierten Rechengang gewählt (vgl.
3.1.1).
wurde hier bei
Beibehaltung des Zahlenwertes für einen unkomplizierten Rechengang gewählt (vgl.
3.1.1).
|
Aufgabe: |
| Gegeben: |
Das Volumen einer Wasserstoffportion Vn (Wasserstoff) = 25,5 l Die Dichte des
Wasserstoffs im Normzustand:
|
| Gesucht: | Die Masse der Wasserstoffportion |
|
Rechengang |
Gleichung 5 wird nach der gesuchten Größe entwickelt. Einsetzen der Werte.
![]()
Der Index bei Vn und
![]() bedeutet: im
Normzustand (0 °C, 1013 hPa).
bedeutet: im
Normzustand (0 °C, 1013 hPa).