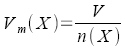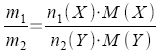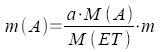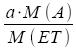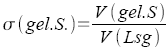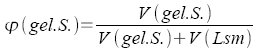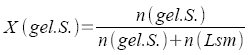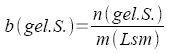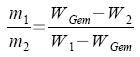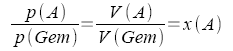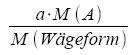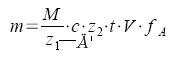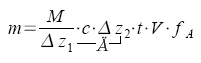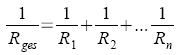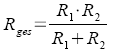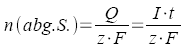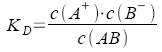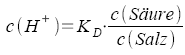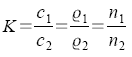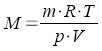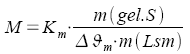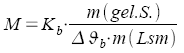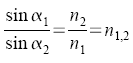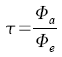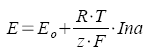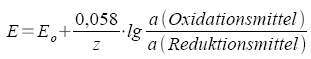| Nr. |
Größe,
Gesetz |
Größengleichung (Formel) |
Bemerkung |
|
82
83 |
Viskosität,
dynamische
(Meßverfahren
nach Höppler)
Viskosität,
kinematische |
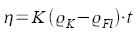 |
Einheit Pa * s, mPa * s K: Kugelkonstante
ρK: Dichte
Kugelmaterial
pFl: Dichte
Flüssigkeit
t: Fallzeit der Kugel |
 |
|
84 |
Elektrolyte
Massenwirkungsgesetz "MWG"
Gleichgewichtskonstante
Für Rechnungen anzusetzen |

Ebenso
Kp
für Gase
Kc
für Lösungen
 |
Reaktion
aA + bB ↔ cC + dD
n: Stoffmenge
p: Druck
c: Konzentration
Kc analog |
|
85 |
Dissoziationsgrad |

|
N: Anzahl der
Moleküle |
|
86 |
Dissoziationskonstante |
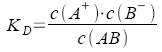
|
Reaktion AB
↔ A+ + B- |
|
87 |
Ostwaldsches
Verdünnungsgesetz |

|
≈ für praktische Rechengenauigkeit,
bei α < 1% |
|
88 |
Elektrolytische Leitfähigkeit |
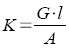
|
l: Abstand der
Elektroden
A: Fläche der
einzelnen Elektrode |
|
89 |
Molare
Leitfähigkeit, Äquivalentleitfähigkeit |
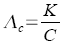
|
c in mol/ml |
|
90 |
Beziehung
zwischen α und Λ |

|
Λo: Maximalwert,
Grenzwert |
|
91 |
Ionenprodukt
des Wassers |
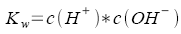
|
Kw =
KD(H2O) * c(H2O)
Zahlenwerte s.
Tabellenbuch |
|
92
93 |
pH-Wert |
pH = -lg {c(H)} {c(H+)}
= 10-pH |
c in mol/l {}
heißt: "Zahlenwert von"
H+
sind hydratisiert |
|
94
95 |
Gleichioniger
Zusatz, Puffern, Abstumpfen |
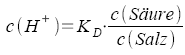

|
- |
|
96 |
Löslichkeitsprodukt |
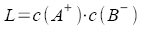
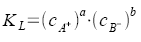
|
Für AB
↔ A+ + B-
Für AaBb ↔ aA+
+ bB- |
|
97 |
Verteilungskoeffizient
(Nernstscher
Verteilungssatz) |
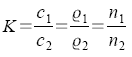
|
Konzentration
oder Stoffmengen zweier Komponenten |
|
Molare Masse |
|
98
99
100
101
102 |
Aus Gasgesetzen
Aus Dampfdruckerniedrigung
Siedepunkterhöhung
|
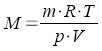 |
- |

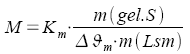 |
|
b: Molalität, vgl.
28
Km: molale
Gefrierpunkterniedrigung, Kryoskopische Konstante
Kb: molale Siedepunkterhöhung,
Ebullioskopische Konstante
Zahlenwerte s. Tabellenbuch |
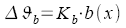
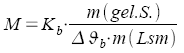 |
|
103
104 |
van´t Hoffscher
Koeffizient |
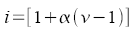
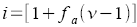 |
α: Dissoziationsgrad
ν: maximale Anzahl der Ionen eines
Moleküls
fa: Aktivitätskoeffizient |
|
Optische Meßverfahren |
|
105 |
Refraktometrie Brechungsgesetz |
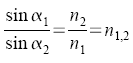
|
Medien 1 und
2 ni: Brechzahlen |
|
106
107
108
109
110 |
Photometrie Durchlässigkeit
Absorption
Extinktion
Lambert - Beersches Gesetz |
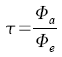
|
Φ: Lichtstrom,
a austretend,
e eintretend |
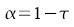 |
- |
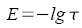 |
- |

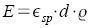 |
ε: molarer Extinktionskoeffizient
εsp: spezifischer
Extinktionskoeffizient
c(X): Stoffmengenkonzentration der
Teilchen X |
|
111 |
Polarimetrie Drehungswinkel |
 |
d:
Schichtdicke Küvette ρ*:
Massenkonzentration des gelösten Stoffes |
| [α]:
spezifischer Drehungswinkel |
|
Elektrodenpotentiel und Elektromotorische Kraft |
|
112
113
114 |
Elektrodenpotentiel und Elektromotorische Kraft
(Nernstsche Gleichung) |
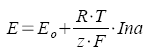 |
Eo:
Standardpotential
R: Gaskonstante
T: Absolute
Temperatur
z: Ladung des
Ions
F: Faraday -
Konstante
a: Aktivität des
Ions in der Lösung
Für praktische
Rechnungen

und
In zu lg zusammengefaßt:
bei 15°C 0,057
bei 20°C 0,058
bei 25°C 0,059
Zur
Berechnung von Redox - Potentialen z. B. in der Maßanalyse |
 |
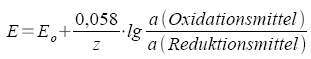 |
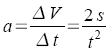
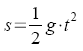
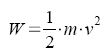
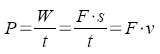
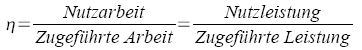
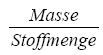 ,
,