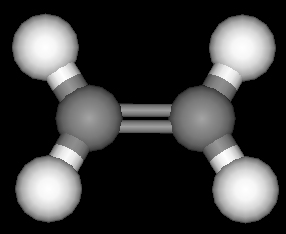
Struktur der Alkene
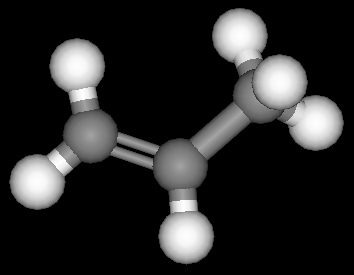
Die räumliche Anordnung der Atome im Molekül lässt sich auch bei den Alkenen an Molekül-Modellen am besten übersehen. Das einfachste Molekül hat das Anfangsglied dieser Reihe, das Ethylen (Ethen) C2H4.
Beim Aufbau der Modelle müssen wieder die zwei Grundtatsachen der Struktur von C-Verbindungen berücksichtigt werden: die Vierwertigkeit des Kohlenstoffs und des Tetraedermodell für die Richtigkeit der vier Valenzen.
Ethylen C2H4 (Ethen)

Aus der Formel C2H4 folgt, daß zwei Valenzen der beiden C-Atome nicht durch Wasserstoff abgesättigt sind, wenn man davon ausgeht, daß von den insgesamt 8 Valenzen beider C-Atome 2 zur Bindung der C-Atome untereinander und 4 zur Bindung der vier H-Atome an Kohlenstoff verbraucht werden. Um die zwei noch "freien" Valenzen unterzubringen, wird zwischen den beiden C-Atomen eine zusätzliche Bindung hergestellt; im Ethylen C2H4 werden also die beiden C-Atome durch eine Doppelbindung miteinander verknüpft. Während bei den Alkanen ausschließlich Einfachbindungen zwischen den C-Atomen auftraten, enthalten die Alkene mindestens eine Doppelbindung; daneben sind im Molekül auch Einfachbindungen vorhanden.
Für den eingangs erwähnten ungesättigten Charakter der Alkene ist also eine Doppelbindung verantwortlich. Die hier zur Doppelbindung der C-Atome untereinander zusätzlich verbrauchten Valenzen können nicht mehr durch Wasserstoff ersetzt werden.
Mit dieser Vorstellung kann für Ethylen die Elektronen- und auch die Valenzstrichformel aufgebaut werden, wenn jedes bindende Elektronenpaar durch den Valenzstrich ersetzt wird.
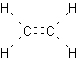 |
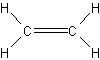 |
CH2=CH2 | C2H4 |
| Elektronenformel | Valenzstrichformel | rationelle Formel | Summenformel |
Jedes C-Atom betätigt 4 Valenzen, wie die Strukturtheorie fordert, und die Doppelbindung besteht aus vier Elektronen oder zwei Bindungselektronenpaaren.
Wasserstoff wird an Kohlenstoff immer einfach gebunden. Jedes Atom, für sich betrachtet, besitzt Edelgaskonfiguration an Elektronen, ein Oktett bzw. Dublett (beim Wasserstoff).
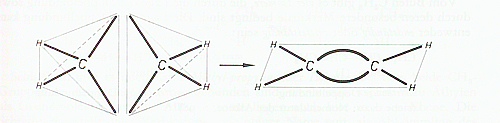
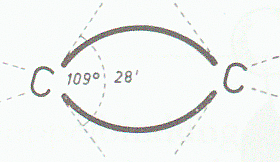
Die Doppelbindung des C2H4 und auch aller anderen Alkene lässt sich im Molekülmodell dadurch erreichen, daß die beiden Tetraeder jedes C-Atoms mit einer Kante aneinanderstoßen. Das Modell zeigt, daß dabei ein ebenes Molekül entsteht; die beiden C- und die vier H-Atome liegen in einer Ebene. Die beiden Bindungen der Doppelbindung zwischen den C-Atomen liegen über und unter der Molekülebene, aber ebenfalls in einer Ebene (Doppelbindungsebene), die zur Molekülebene senkrecht steht.
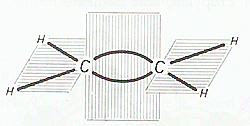
Die Valenzwinkel der Kohlenstoffvalenzen bleiben zwar erhalten, werden aber bei Bildung der Doppelbindung stark aus der Normallage abgebogen.
Propylen C3H6 (Propen)
Propylen besitzt drei C-Atome; diese werden durch eine Doppelbindung und eine Einfachbindung miteinander verbunden:
 |
CH2=CH-CH3 | C3H6 |
| Valenzstrichformel | rationelle Formel | Summenformel |
Das Molekülmodell des C3H6 lässt sich vom Ethylen ableiten, wenn ein H-Atom durch die CH3-Gruppe ersetzt wird. Deswegen liegt auch das C-Atom der hinzutretenden CH3-Gruppe in der Molekülebene des Ethylens.
Butene C4H8
Vom Buten C4H8 gibt es vier Isomere, die durch die Lage der Doppelbindung sowie durch deren besondere Merkmale bedingt sind. Die Lage der Doppelbindung kann entweder endständig oder mittelständig sein:
| CH3-CH2-CH=CH2 | CH3-CH=CH-CH3 |
| Buten-(1) | Buten-(2) |
| endständige Doppelbindung | mittelständige Doppelbindung |
Das Molekülmodell des Butan-(1) zeigt dieses Bild:
|
|
Drei C-Atome bilden, wie beim Propylen, eine Molekül-Ebene; das C-Atom 4 (CH3-Gruppe) besetzt eine der Valenzen des C-Atoms 3 und liegt deswegen nicht in der Molekülebene. Welche Stelle die CH3-Gruppe am C-Atom 3 einnimmt, ist gleichgültig und führt nicht zu einem neuen Isomer, da beide C-Atome (3 und 4) sich um die Einfachbindung zwischen den C-Atomen 2 und 3 drehen können, Theorie der freien Drehbarkeit. Es gibt deswegen nur ein Buten-(1). |
Für das Buten-(2) gibt es jedoch zwei weitere Struktur-Möglichkeiten und damit zwei Isomere. Das Buten-(2) kann man vom Ethylen ableiten, indem je ein H-Atom an den beiden C-Atomen durch eine CH3-Gruppe ersetzt wird. Im Falle a liegen die CH3-Gruppen auf der gleichen Seite der Doppelbindung (cis), im Falle b auf verschiedenen Seiten (trans).
| a) Buten-(2)cis |
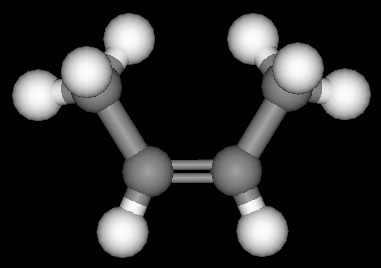 |
| b) Buten-(2)trans |
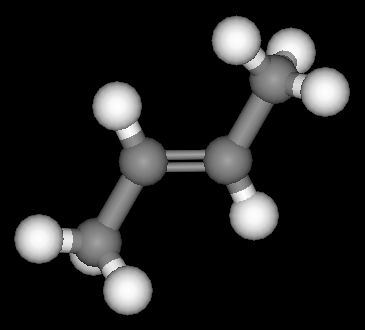 |
Ein Umklappen der beiden Strukturformen ineinander kann nicht mehr eintreten, da die freie Drehbarkeit um die (C=C)- Bindung durch die Anwesenheit der Doppelbindung unmöglich geworden ist. Die freie Drehbarkeit einer (C-C)- Einfachbindung wird durch den Eintritt einer Doppelbindung aufgehoben. Alle vier C-Atome des Buten-(2) liegen in einer Ebene.
Die cis-trans-Isomere stellt man auch in der üblichen Schreibweise der Valenzstrichformeln entsprechend dar:
 |
trans.gif) |
oder |
cis.gif) |
| Ethylen | Buten-(2)trans | Buten-(2)cis |
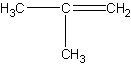
Schließlich gibt es noch das 2-Methyl-propylen oder Isobuten, bei dem beide CH3-Gruppen an das gleiche C-Atom gebunden sind, wenn man wieder vom Ethylen als Grundmolekül ausgeht. Alle C-Atome liegen auch hier in einer Ebene. Die Schreibweise stellt diese Verbindung, wie obiger Name sagt, als Abkömmling des Propylens dar:
 |
 |
| 2-Methyl-propylen oder Isobuten | 2-Methyl-propylen oder Isobuten |